
美国药典通则<1469> NITROSAMINE IMPURITIES(以下称通则)于2021年12月1日正式实施。该通则为亚硝胺杂质的控制提供了一种基于科学和风险的方法,对原料药和制剂中潜存的亚硝胺杂质进行有效的识别、评估并控制。通则主要提供了两方面的建议:
a) 建立亚硝胺的控制限度,确保这类杂质的减少或消除;
b) 提供了用于监测亚硝胺水平的分析方法及方法的验证要求。
亚硝胺类杂质属于高**基因毒类杂质,它可以通过多种途径被引入到医药产品中或作为杂质产生。它的反应机理主要是,在酸性条件下,仲胺或叔胺与亚硝酸盐(后者通过中间降解)发生化学反应形成亚硝胺。通则中给出了仲胺形成亚硝胺的化学反应示意图如下:
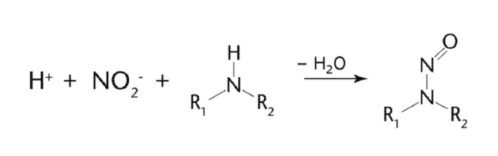
通则适用于七种亚硝胺的评估,包括:N-亚硝基二甲胺(NDMA)、N-亚硝基二乙胺(NDEA)、N-亚硝基二异丙胺(NDIPA)、N-亚硝基乙基异丙胺(NEIPA)、N-亚硝基二丁胺(NDBA)、N-亚硝基甲基苯胺(NMPA)和N-亚硝基甲基氨基丁酸(NMBA)。该清单与 FDA 亚硝胺杂质指南中的亚硝胺清单完全一致。如果出现上述列举之外的亚硝胺杂质,生产商需基于其**数据设定限度,并与监管当局确认。
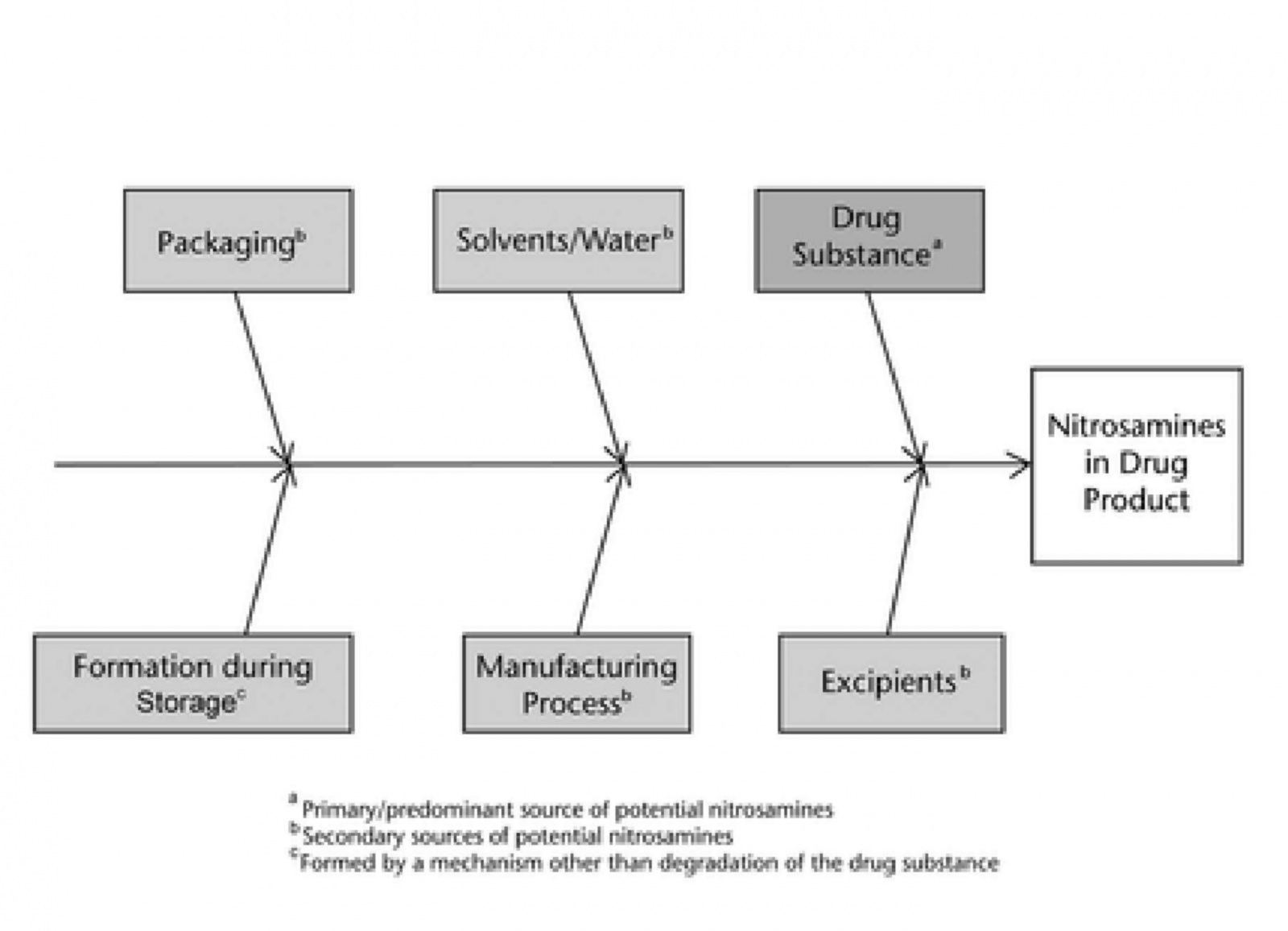
根据经验或文献报道,通则总结出亚硝胺的主要几个来源:
与FDA及其他官方对亚硝胺杂质的控制思路一致,通则要求对潜在的亚硝胺杂质进行风险评估,充分考虑引入亚硝胺的所有潜在来源,包括原料药、赋形剂、水、溶剂、制造工艺、包装成分和配方稳定性。
通则指出,7种已知的亚硝胺杂质具有潜在的和已确定的**,没有治疗价值。USP遵循FDA亚硝胺杂质控制指南中对这7种亚硝胺限度的设定标准。NDMA 和 NMBA 的可接受摄入量(AI)为 96 ng/day,NDEA、NMPA、NIPEA 和 NDIPA 的可接受摄入量(AI)为 26.5 ng/day。再根据药品标签上原料药(DS)的最大日剂量(MDD,毫克/天),来计算单个药品的最大亚硝胺可接受限度。

如果在一种制剂或原料药中同时检测到多个亚硝胺杂质,且按最大日剂量(MDD)算得总的亚硝胺水平超过26.5ng/day,生产商需与监管当局确认合适的可接受摄入量(AI)限度。
由于亚硝胺类杂质每日允许暴露量非常低,只有纳克级别,所以就要求使用特别灵敏的分析方法来进行亚硝胺的检测。在大部分情况下推荐使用高灵敏度高选择性的色谱分离技术联合质谱进行定量检测(例如,HPLC-MS/MS,GC-MS/MS)。
适当的样品制备在痕量杂质分析中非常关键。不恰当的样品制备程序可能人为导致亚硝胺杂质的生成或损失。对于亚硝胺杂质的分析方法验证的要求,如果是定量分析方法,验证建议包括范围、准确度、重复性、中间精密度和定量限。如果是限度测试,则要包括专属性、回收率、可检测性和溶液稳定性。
为了帮助供应商更好地检测亚硝胺杂质,通则提出了四种定量的分析方法(见8.1 Quantitative Procedures)。对于这四种定量分析方法,只需要做药典方法的确认。
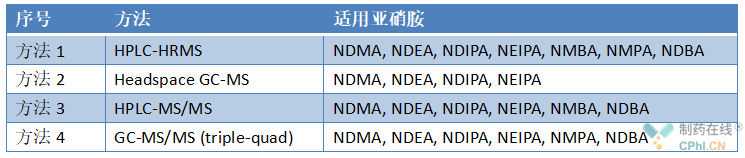
对于限度测试,该通则中未提供方法,只给出一个样品制备程序(见8.2 Limit Test Procedures)。更多详细信息,请参见USP <1469> NITROSAMINE IMPURITIES。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57