在药物分析活动中为使测试结果准确可靠,必须对采用的分析方法的准确性、科学性和可行性进行验证,以充分表明分析方法符合测试项目的目的和要求,这就是我们通常所说的要对分析方法进行验证。我们所使的检验方法理论上都应是经过验证和确认的,从法规的角度来说,你在实验室应用的无论是原料、辅料、中间体、成品,所有的分析方法都应该是经过验证的,是一个基本要求。
哪些情况需要验证分析方法呢,一般包括以下几种情况,包括刚开发的分析方法(建立新方法),修正或建立分析方法用于新的问题,分析方法变更如相确定清洁验证过程中对活性残留的检测方法,这种检测方法一般都是由产品的含量检测方法来转化的,分析方法在不同实验室和分析人员中使用,分析方法在不同的仪器是使用,证明两个分析方法的等效性等。
分析方法验证的具体指标有那些:
验证的指标有准确度、精密度、专属性、检测限、定量限、线性范围和内容性。
下文解释一系列名词,准确度和精密度,准确度是指在真实值或认可的参考值与测量值之间的相近程度。
精密度是指在规定条件下对均质样品多次取样进行的一系列的检测结果的接近程度,精密度可以从重复性、中间精密度、重现性三个层次考察。
在相同操作条件下较短的时间间隔的精密度称为重复性,实验室内部条件改变等情况下的精密度称为中间精密度,不同实验室之间的精密度称这重现性。
专属性是指在一些可能存在的组分如杂质、降解物、基质等对被分析物准确可靠测定的能力。像鉴别实验、杂质检测和含量测定均需考察专属性。
检测限是指样品中被分析物质能够被检测到的最低量,但不一定是准确定量。检测限反映方法是否具备足够的检测灵敏度,常用的方法有直观法,信噪比法、标准偏差和斜率法。 定量限是具有合适的准确性和精密度的条件下,能够定量测定分析组分的最低限度,定量限体现分析方法是否具备灵敏的定量检测能力,微量衡量药物分析,定量测定杂质和降解产物时就确定方法的定量限。
线性是指在给定的范围内检测结果与样品中被分析物质的浓度成比例关系的能力,范围是指达到一定的精密度、准确度和线性条件下测试方法适用的高低限浓度或量的区间。
耐用性是指参数适当发生细小变化时测量能力保持不受影响,可用于说明正常使用时的可靠性,用于为日常检验提依据的分析方法。典型的变动因素有样品提取次数和时间、被测溶液的稳定性,液相色谱的典型变动包括流动相组成pH、色谱柱、温度、检测波长。
分析方法验证具体有哪些步骤?
以图片形式概括:
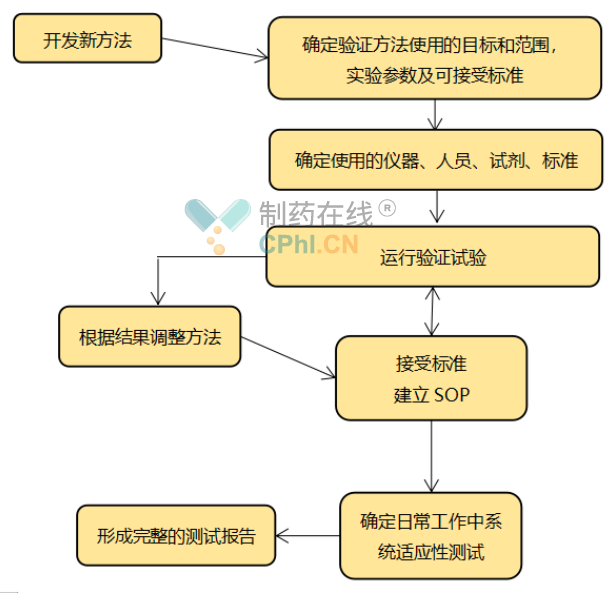
新方法的验证步骤包括开发新方法,确定验证方案确定实验参数及及接受标准,验证使用的仪器人员、试剂、运行验证实验。根据结果调整方法或接受标准运行,完成验证实验,建立该方法的SOP,确定日常工作中系统适应性试验,最终完成完整的验证报告。
方法转移
我们在实际的工作中牵扯的方法转移的情况是非常多的,比如说最常见的我们方法研发的实验室转移到产品检验(QC)实验室,这个也是一个方法的转移,一个大的制药集团从研发转移到QC这也是一个转移,这是不同的实验室之间的转移,方法接收的实验室在使用这个方法。接收方法的实验室就需要证明其能够成功的在本实验室中运行该方法,这也是方法转移。
还有一些转移的情况,诸如由于生产线的转移使分析方法从A生产地点转移到了B生产地点。分析方法由MAH公司转移到了合同加工公司。它的方法开发了以后是一定要转让出去的。甲公司购买了乙公司的产品,方法由甲公司转移到了乙公司。包括药品的原料、辅料等。这些都会涉及到方法的转移。
目前对于很多的制药企业来说都建立了内部转移的指导文件,也就是我们的方法转移标准操作规程。现在2020版的药典有一个明确的指导原则,不用像以前一样,要么是做的太多,要么是做的太少。
分析方法转移的概念包括三个要素,方法建立实验室、方法接收的实验室和比对性实验。所谓的转移就必须至少包括2 个实验室,一个是方法建立的实验室一个是方法接收的实验室。方法建立的实验室负责分析方法的建立和验证,当其它实验室需要按照以经建立好的方法进行检验时,这些实验室统称为方法接收实验室。
方法接收实验室需要证明其能够成功的在本实验室操作该方法,最常用的方法就是对比性测试。如果接收实验室采用该方法对样品测定的结果与方法建立实验室测定结果符合相关的接受标准,证明方法接收实验室能够操作此方法,方法转移证明是成功的。
被测样品的数量和方法的重要性、复杂性和接收实验室此前是否有操作此类方法的经验有关,所以在方法转移之前,要注意确保方法接收实验室工作人员对方法中涉及的关键参数有详细的了解,很重要的一点是转移程序对操作关键参数的说明也要详细。转移程序还要明确双方实验室的职责,进行一个良好的沟通,同时确定各种参数的可接收范围。
对比性测试中需要考虑的因素主要包括:
1. 要提供若干批次的测试样品(如2-5批)
2. 被测样品的浓度级别(1-3个浓度)
3. 重复测定次数(4-6次)
4. 分析时间(1-3天)
5. 分析仪器(型号相同或者不同)
如果我们是做新药研发的,对于进口药品的注册标准,药监机构涉及方法转移的一项重要工作就是进口药品的质量标准的复核,进口药品的质量复核,根据我国《药品注册管理办法》的规定,当国外药品申请在中国上市时,需要报送3批样品在中食药品检定研究院或各口岸的检验机构进行药品质量标准的复核,同时提交相应的分析方法,方法学验证以及3批样品的出场检验结果。这个就是一个最典型的方法转移,我们在拿到质量标准的时候,首先要查各国药典美国、英国、欧洲、日本、中国药典,看这个品种的收载情况,进行方法的比较,限度的比较,并不是说你提供的标准就要照着做一遍就OK了,比如说有关物质,我们可能要做一个检测限,含量对三批结果进行一个比对,我们做出的三批与报告单进行一个比较。针对具体企业间转移的品种可能就更复杂一些。
方法的确认
在日常的检验工作中,经常方法确认和方法转移以及方法验证这3个概念相混淆,尤其是方法确认,大家的理解各不相同,做法各异。方法确认的核心有三点,首先确认的是药典的分析方法或法定的分析方法进行确认,你建立一个新方法一定是法定的方法。第二证明药典分析方法或法定的分析方法适用于被测样品,被测样品质量可控,方法可行。第三证明方法的使用人员有能力成功的操作药典分析方法或法定的分析方法。比如说研发人员在对药典的方法对研发的产品进行检验的时候,不可能再进行好多的验证,我们是通过系统适应性试验证明操作人员能够成功的来操作药典的分析方法。
关于方法的确认,WHO、 ISO17025、 FDA 、USP发布的指导原则,国际上权威的机构的共同意见是,只要是方法确认。一定是药典的分析方法或法定的分析方法,对于第二点和第三点来说,WHO、 FDA 、USP的侧重点就有所不同。
WHO 在药品质量控制实验室操作规范是明确指出,方法确认是证明一个药典的分析方法或经过验证的法定分析方法适用于本次检验的过程。WHO的定义侧重于强调第二点,证明药典分析方法对产品的适用性。
ISO17025 、FDA 、以及USP对分析方法确认的定义基本上可以总结为,检验室验室和方法使用者应该证明其对药典方法有充分的了解并且有能力重现药典方法,可见ISO17025 、FDA 、以及USP对方法确认侧重于第三点,强调检测实验室人员和检验人员操作药典方法的能力。
如果将WHO和FDA以及USP的定义结合起来,就是说一个相对完整的方法确认是证明药典分析方法或法定分析方法适用于被测样品,被测样品质量可控,方法可行,同时还证明方法使用人员有能力成功操作药典分析方法和法定分析方法。
药品分析实验室在采用药典分析方法或法定分析方法进行检验时,不需要对分析方法进行验证,但需要对分析方法进行确认,以证明承担检验的实验室能够正确操作药典方法。具体确认那些内容,则没有明确的规定,应根据方法本身的特点和检验人员对方法操作的熟练程度由检验室自己确定。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57