
物料和产品的质量标准质量保证体系重要组成部分,如果质量标准制定的不合理就会对产品质量造成错误的判断,严重的对产品安全性产生影响,所以企业正确的制定产品的质量标准对于产品质量保证来说是非常关键的一个环节。质量标准提供了一个界限,就是如何来保证产品质量,也使企业不断的提升工艺水平来保障产品的质量。
质量标准的制定原则首先就是要保证产品安全有效,凡是影响药品安全有效的因素都应考虑制定标准。在质量标准制定时,仔细研究、分析、选择。质量标准的制定要具有一定的先进性,随着新的技术的发展,我们的质量标准也是在不断的提升的。在制定药品质量标准的过程中,尽可能采用较先进的方法和技术。针对性原则,要从生产工艺、流通、使用各个环节了解影响产品质量的因素,有针对地规定检测项目。在制定新药的质量标准时,要按照国家局定的基本原则、基本要求和一般研究规则进行。
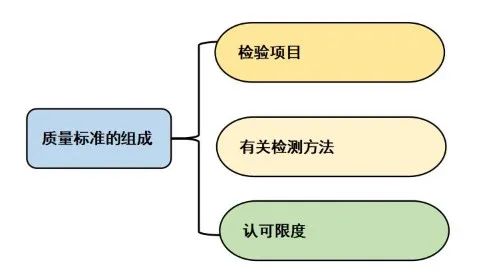
ICH Q6中,质量标准是由一系列的检测项目、有关检测方法和认可的限度组成,这些认可限度以限度值、范围或者描述来表示,对于定量的检测项目一般是以限度值来表示,对于定性的检验项目会用描述来表示。质量标准建立的目的就是为了让原料药和制剂必须要遵循的并且与其用途相适应的认可标准。我们常说的符合标准就是按照质量标准给定的方法检测。结果是符合所建立的认可限度的。也就是检验所使用的方法也是事先规定的,而不能随意选择方法。
对于质量标准的分类,按照药品生命周期的阶段来划分的话,可以分为药品上市前的质量标准和商业化生产时的质量标准,ICH Q6对于新原料药、制剂、生物制品在注册上市前的质量标准的建立也有详细的指导。
质量标准认为是产品质量控制策略的重要组成部分,它总体的控制策略不单单包括质量标准,还包括了原材料和辅料的控制,生产工艺过程的检测,还有工艺评估、验证、GMP执行情况、稳定性研究的情况、批间致性的检测等等。综合这些要素,才能够保证产品的质量。质量标准的制定只是进一步的来确认原料药及其制剂或者是生物制品的原液、中间体、成品的质量。并不是体现了产品所有的性质,所以在质量标准中应重点设定的是能够反映药物安全性和有效性的检测项目。基于以上的考虑,在研发阶段制定质量标准主要考虑以下方面:

在确定了质量分析的项目以后,就应该为这些质量特性的分析项目建立适宜的分析方法,建立分析方法的时候要考虑确定标准品、参照品,对于创新药来说有时候不容易得到标准品,就应建立自己的一级参照品,所以一定要经过质量特性分析,所采用的批次应是生产、临床研究用样品的代表性批次进行制备。如果能够获得适宜的标准品,应该尽可能的使用,来标定自己的工作标准品。对分析方法进行验证,确认方法的可靠性。
工艺控制方面,从开发初期到规模化生产所积累的关键资料,为制定合理的接受限度提供了可靠的依据。需要说明的是如果某些特定的杂质被证明了它在工艺中可以有效的控制,并达到一个可接受的水平,就不必对产品中的杂质进行检测,也不必纳入到质量标准中。
原辅料质量标准对制剂的质量标准影响也很大,原辅料的质量应该符合与其用途相适应的标准,如果已经有了药典标准并且使用的时候,尽量选用药典标准,甚至比药典标准更严的。药典凡例和制剂通则中也是规定了与产品评价相关的分析方法和可接受标准。比如说在通则中的无菌检查、内毒素检查、无菌限度检查、装量差异、可见异物等都是对不同的制剂的检测要求。
研发阶段制定的这些质量标准都是应该由生产企业经论证在注册申报材料中提出来,经过批准之后,作为批准产品的依据。
商业化生产阶段生产的成品及原辅料、包装材料等质量标准的依据就是我们在产品注册申报时上报的质量标准。

在实际执行的过程中可能会对产品的质量风险制定比法定标准更为严格的标准,所以按标准的限度分类的话,可以分为法定标准和内控标准,内控标准我们了称为放行标准,法定基准也可称之为产品的货架期标准。根据对产品上市后的风险评估,可能要制定比货架期更严格的放行标准。
质量标准建立的法规要求。





本文图片来源于作者
从这些法规的要求可以看出,必须要把药典或者注册标准转化成为企业自己的质量体系文件,将文件标准化或是体系化。我国药品与国际化接轨程度算是比较高的,质量标准来源于产品质量本身,产品质量无法通过检验赋予而是通过设计赋予的,质量标准是质量体系的重要组成部分,但不是唯一的内容。加强对自己产品认知的提升,质量标准也会不断的提升和加强,才能够找到准确的控制点。
作者简介:
@A001,一名走在制药路上的小奋青,从事制剂生产质量管理,扎根现场十二年,质量体系的践行者与监督者。
相关阅读:



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57