
药品在共线生产过程中,有效的清洁方法是防止同品种间和不同品种间的污染和交叉污染的重要手段,为此生产企业需要制订生产设备的清洁规程,有时还需制定不同品种各自的清洁规程,为证明清洁规程的有效性,有们需要进行确认和验证,证明设备在使用后再清洁,清洁的效果是符合我们的要求的,当然经过验证后,如果遇到在原有生产线上增加了新的品种的话,可能就会涉及到清洁方法是否有依然有效的问题,如果经评定新增品种更加难以清洁,那么就需要进行清洁程序再验证,验证后会得出两个结果,第一种结果验证通过,原有的清洁规程可以适用于新增加品种的清洁,新增品种按现有清洁规程清洁就可以。第二种结果就是验证不通过,现在的清洁规程不适用于新品种的生产,需要开发新的清洁方法,顺便说一句,新产品进入车间之前,研发部门就应对预计进行车间的这个新品种的理化性质等进行一个评估,了解它的去除方法,对现有清洁规程的适用性有一个评估,否则在进入车间再去做这件事,也许会有些来不及。如果清洁验证不通过,说明还有产品残留在设备上,那你的设备在没有清洁干净之前怎么使用?怎么评估对下一产品的影响。
这也是笔者现在所遇到的问题,第一个问题是我车间计划引进行了一个新品种,准确的说是MAH想在我们的生产线上生产,我们生产线上只的一个品种,假如增加后就变成了两个,涉及了共线生产,因此需要进行清洁验证,MAH方面,进行了清洁分析方法的验证,并完成了转移,我们QC又依据清洁分析方法进行了再验证,分析方法验证通过。核对完生产设备,进行设备比对,觉得可行,就进行了试生产,生产完成后,按我车间原有的清洁规程进行了清洁,我们进行了清洁验证取样,结果发现检验结果不合格,并且送检的空白取样棉签也是不合格的,这说明有问题啊,要么取样工具对检验有影响,要么产品残留不合格,后来在下一次中试生产后又进行了取样检测,所有取样结果和空白样品依然不合格。所以可以看出我们对产品的了解的不深入,MAH与我们交接时没有重视清洁的问题,导致出整个项目的进度受阻。
结合我们清洁验证的失败,我总结了清洁验证失败有关的因素供大家参考,可能不是适用于所有剂型或企业,就当是供大家吐槽了。
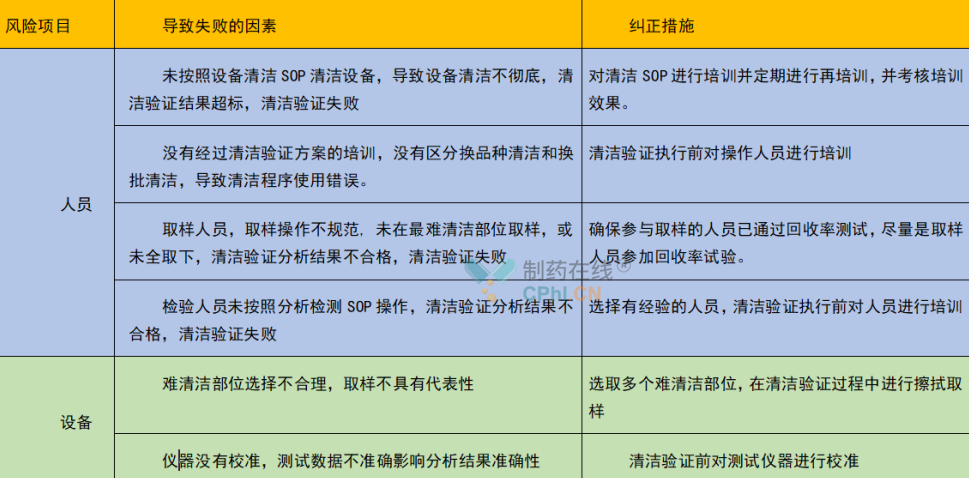
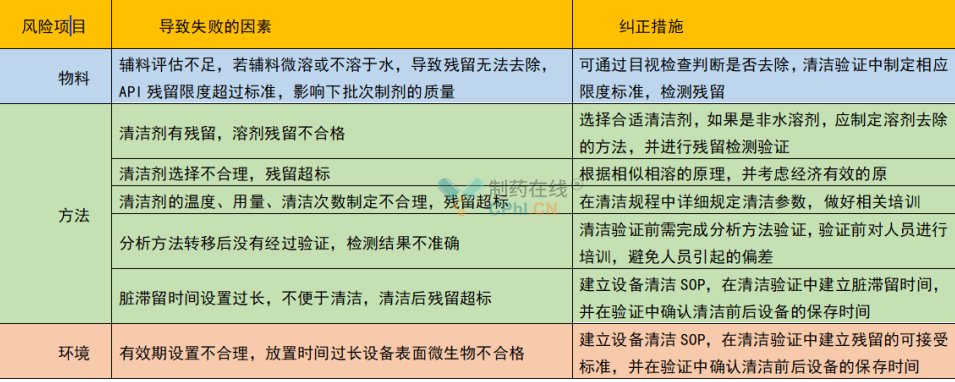
笔者遇到的问题第二个问题就是,对于复方制剂,一种产品是有多种活性成分,如果我们都对所有的活性成份都进行接受限度的计算,在取样后都进行分析,也是可行的,但这样通常需要制定多个分析方法验证方案,针对每一组分,无形中增加了许多工作量,值得考虑的是从复方制剂的活性成分中再进行筛选,结合溶解性、LD50值、PDE、颜色、气味等,选择种或者两种活性成份来进行清洁验证,如果有可能也可以把几种活生成份的检测方法融合在一个分析方法中,一次进样全部分析出来。这样既减少了工作量,也把活干了,可以尝试一下,也可能我所想到的,有的企业已经做了。
第三个问题,关于清洁验证的周期问题,如果您共线生产的品种有很多,那么相应的您验证所采用的品种就会多,这取决了不同品种所采用不同的清洁规程,每一操作规程都要选择最差品种进行验证,也就是所有清洁方法都要经过验证证时是有效的。清洁验证的周期就会很长,还有就是法规所关注的与清洁验证有关的几个重要条件,法规要求连续生产的最长时间、设备使用后至清洁前的间隔时间以及设备清洁后的保存时限对清洁效果的影响。把上述条件都考虑进去,我们要在生产安排时创造这样的苛刻条件进行验证,有时候生产安排并不是这样,我现在遇到的问题就是,清洁有效期的验证,我们计划将新产品的清洁后的有效期定为10天,但我们现在生产任务紧,设备不能放置那么长的时间,所以只能等有条件的时候再做这个条件,当然也有人说,可以将设备清洁后的一个部件进行放置,比如说放置一个料斗的盖子,在同样的条件下放置起来,等到时间了,取样检测微生物是否还处理可接受的限度内(大家讨论一下,如果可行我们也这样做),如果我们具备这样的生产条件,那还要来三个循环。所以说一般清洁验证的时间会拉的很长,这是我深有体会的,一条线也一个月的时间在放置,如果是连续生产验证+清洁后的有效期,这样的条件对于我们目前来说,是比较难创造的,如果你放置的这个操作间有其他设备,那放置期间其它设备也是不能用的,说这些也就是前期我们的生产安排要合理,“创造”验证条件,密切关注生产情况,认真研究生产安排争取尽早做完。
最后一个问题,就是沟通问题,在验证过程中我们都是要针对方案进行相关人员的培训的,但有时还是会出现差错,我记得有一次在清洁完成后还没有取样,生产人员就进行下一品种的生产了,直接导致偏差,为啥呢,因为我培训了方案内容以后,遇到生产安排调整,又过了一阵子才生产清洁验证品种,操作人员都把要验证这事忘了,我在生产前也没有说,所以双方都有责任,没办法只有制定了CAPA,争取以后不要再出现同样的问题了。沟通无处不在,良好的沟通的任何时候都是有益的。
上文笔者的这些案例,问题主要是讨论了,对于分析方法转移研究的不够充分,和产品的预清洁测试没有做好,如果问题发生在试验阶段,是好解决的,当直接进行验证时,影响到了共线生产的所有品种,就有点损失大了,所以说对于清洁验证的前提条件我们一定要做好,人员培训与再培训有做好,验证活动中沟通的及时性上,进行了个人观点的表达,还有上述图表中的因素我们应如何有效避免等,总之清洁验证是涉及多部门的共同参与,需要验证负责人具有一定的沟通协调能力的,这样才能增加验证的成功率,对于清洁验证的研究本人也是处于起步阶段,希望通过案例引发一些思想踫撞,对清洁验证有一些新的理解。
作者简介:@第一单打,非常热爱制药行业,对工作有着十分饱满的工作激情。从事质量管理工作中积累了大量的实践经验,包括成功的经验和失败的经验。并在行业中拥有广泛的生产一线经验,紧跟政策变化,密切关注新政策对制药行未来的走向,保证企业的合规的路上平稳前行。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57