根据近日江苏省药品监督管理局网站公开信息,上海复星医药(集团)股份有限公司(以下简称“本公司”)控股子公司苏州二叶制药有限公司(以下简称“苏州二叶”)位于苏州市相城区小容量注 射剂车间(编号:209)的小容量注 射剂(非最终灭菌,预灌封注射器)生产线已通过药品生产质量规范符合性检查(即 GMP 符合性检查,以下简称“本次检查”),现就相关情况公告如下:
一、本次检查情况
企业名称:苏州二叶
生产地址:苏州市相城区黄埭镇东桥安民路 2 号
检查范围:小容量注 射剂[非最终灭菌,预灌封注射器,小容量注 射剂车间(编号 209)]
检查结论:符合《药品生产质量管理规范》
二、本次检查所涉生产设施情况
本次检查所涉生产设施为新增小容量注 射剂(非最终灭菌,预灌封注射器)生产线,本集团(即本公司及控股子公司/单位,下同)针对本次检查相关直接投入约为人民币 687 万元(未经审计)。该生产线具体情况如下:
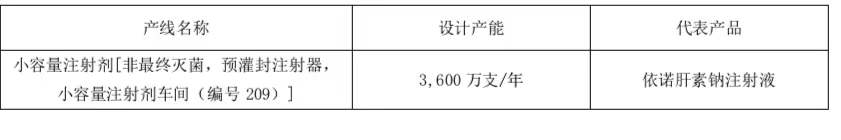
三、相关产品情况
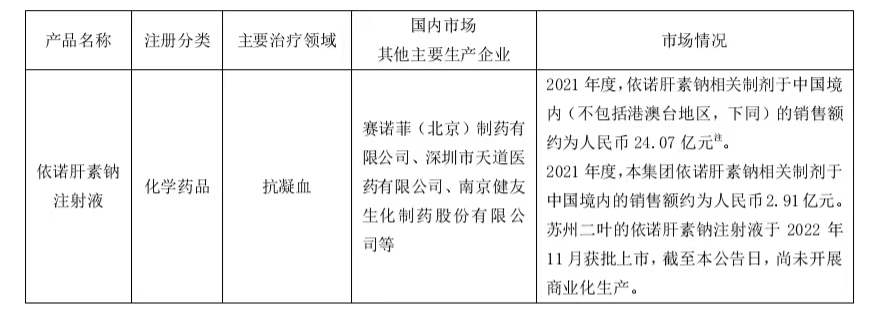
注:上表中市场情况数据由 IQVIA CHPA 提供,IQVIA 是全球领先的医药健康产业专业信息和战略咨询服务提供商;IQVIA CHPA 数据代表中国境内 100 张床位以上的医院药品销售市场,不同的药品因其各自销售渠道布局的不同,实际销售情况可能与 IQVIA CHPA 数据存在不同程度的差异。
四、对上市公司的影响及风险提示
本次通过GMP符合性检查为该新增生产线首次通过GMP符合性检查。本次通过GMP符合性检查不会对本集团现阶段业绩产生重大影响。
由于医药产品的行业特点,各类产品/药品上市后的具体销售情况可能受到(包括但不限于)用药需求、市场竞争、销售渠道等因素影响,具有较大不确定性。敬请广大投资者注意投资风险。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57