提到HIF-PHI类药物,不假思索的就会想到慢性肾病贫血病,提到国内批准上市的HIF-PHI类药物,出现脑海的便是罗沙司他。自2018年12月在国内获批至今,罗沙司他一直是国内HIF-PHI药物领域的“唯一”,独领风骚五年。
如今,随着罗沙司他国内的销售额不断攀升,不少药企看上了HIF-PHI药物领域的“钱景”,不仅一众药企投身HIF-PHI创新药研发,还有一大批布局罗沙司他的仿制药企业正在摩拳擦掌。
首仿之争伊始
近几日,罗沙司他又小“火”了一把。
5月22日,南京正大天晴制药以仿制4类提交的罗沙司他胶囊的上市申请获得CDE承办受理,成为国内首 个报产的罗沙司他仿制药。而就前后脚功夫,5月23日,江苏万邦生化、江西山香药业、成都倍特药业3家企业的产品也火速提交上市申请并获受理,这是罗沙司他自2018年底上市以来首次有仿制药申报上市,而且两天接连4家企业相继报产,一场“罗沙司他”首仿争夺战也随之打响。
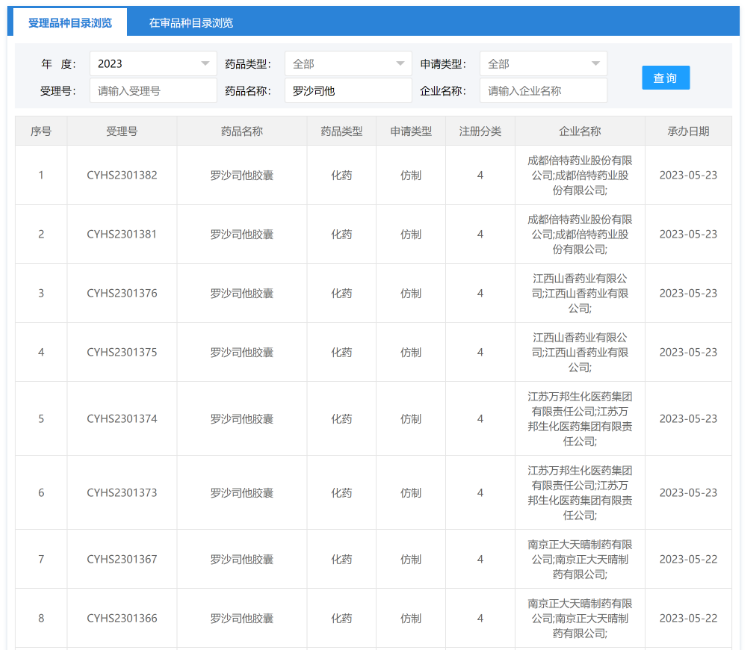
图片来源:CDE 官网
正大天晴制药是国内最早布局罗沙司他仿制药的,也是最早开展BE研究的企业。目前,除了已经报产的4家企业,根据公开数据,国内还有十几家企业开展罗沙司他BE研究,包括齐鲁制药、济川药业等已完成相关试验,后续还会有更多企业报产。
据CDE专利登记平台,罗沙司他化合物专利、组合物专利和医药用途专利到期时间均为2024年6月4日,因此,未来一两年时间,罗沙司他仿制药赛道势必会上演一场激烈的竞速赛。
“矛盾”的罗沙司他
罗沙司他由阿斯利康和珐博进合作研发,是全球首 个开发的小分子低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI)类治疗肾性贫血的药物。
罗沙司他为小分子低氧诱导因子-脯氨酰羟化酶抑制剂(HIF-PHI)类药物。低氧诱导因子(HIF)不仅能使红细胞生成素表达增加,也能使红细胞生成素受体以及促进铁吸收和循环的蛋白表达增加。罗沙司他通过模拟脯氨酰羟化酶(PH)的底物之一酮戊二酸,来抑制PH酶,影响PH酶在维持HIF生成和降解速率平衡方面的作用,从而达到纠正贫血的目的。
2018年12月,罗沙司他全球范围内率先在中国获批上市,商品名为爱瑞卓;,是第一款外资药企研发并在中国完成全球首 发的HIF-PHI创新药物,上市就备受瞩目。
2019年8月,用于非透析依赖性CKD患者的贫血治疗的适应症获得NMPA批准;2019年11月,罗沙司他通过国家医保谈判纳入医保;2021年又通过医保降价谈判降,价格降了近一半;2022年罗沙司他作为国谈药品列入“双通道”药品管理。
可以说罗沙司他在中国一路阳光坦途,销售业绩也是节节高升。根据珐博进和阿斯利康相关财报,经历医保降价谈判,罗沙司他2021年全年为营收13.17亿元,同比增长约12%,销量增长超80%;2022年销量稳步增长,净销售额为约14.6亿元,成为了销量逼近15亿元的大单品。
阿斯利康和珐博进将持续深耕中国市场。2023年5月18日,珐博进宣布,罗沙司他在中国进行的又一项III期临床研究取得了积极的关键数据,该研究评估了对于正在接受化疗的非髓系恶性肿瘤受试者,使用罗沙司他治疗贫血的有效性和安全性。
除了中国之外,罗沙司他的版图拓展到了日本、智利、欧盟等国家地区,其中日本是在2019年获批上市,欧盟地区是2021年获批。
据悉,安斯泰来和珐博进共同负责罗沙司他在日本、欧洲、土耳其、俄罗斯、独联体、中东和南非等国家的开发和商业化。而阿斯利康和珐博进则共同负责在美国、中国、美洲其他市场、澳大利亚/新西兰和东南亚地区的开发和商业化。
然而,在全球多个国家和地区一路顺风顺水的罗沙司他,到目前为止始终无法叩开FDA的大门,美国市场也成了罗沙司他爱而不得的“痛点”。
罗沙司他闯关FDA最大的阻碍便是安全性问题。2021年8月11日,珐博进宣布收到了来自FDA关于罗沙司他关于慢性肾 脏病的NDA的完整回复函,FDA在信中明确表示,目前暂时不会批准罗沙司他的上市申请,并要求珐博进在再次提交上市申请之前进行额外的临床研究。
罗沙司他的美国上市之路道阻且长,何时能登录美国市场,或许时间会给出答案。
HIF-PHI药物研发进展
HIF-PHI是一种新型治疗肾性贫血的小分子口服药物,通过抑制HIF脯氨酰羟化酶,稳定体内HIF水平,进而调控HIF信号通路下游靶基因的转录及表达。HIF‐PHI 通过促进机体内源性生理浓度的EPO生成及受体表达,促进与铁代谢相关蛋白的表达,同时降低铁调素水平,综合调控机体促进红细胞的生成。
慢性肾病是人类健康的“沉默杀手。”我国慢性肾病患者约1.2亿,50%以上患者合并贫血,透析患者贫血患病率高达95%。研究发现,过去二三十年,治疗肾性贫血的主要药物是促红细胞生成制剂(ESAs)和铁剂,但具有一定的局限性:一方面大剂量ESA治疗可增加肿瘤、心血管事件和脑血管事件的风险,故临床在尽量减少ESA剂量的同时,予铁剂纠正缺铁;另一方面,对于功能性铁缺乏的患者,其储存铁处于相对较高水平,过度铁剂治疗使患者更易发生感染、过敏和铁过载等风险,间接增加死亡风险。
相比传统肾性贫血治疗药物,HIF-PHI更有效,且仅需口服给药,患者依从性高,药物一经上市,备受患者青睐。
在全球市场,目前共有六款HIF‐PHI药物获批上市,除了罗沙司他,还有Akebia Therapeutics 的伐达度司他、Japan Tobacco/信立泰的恩那司他和拜尔的莫立司他在日本获批上市、GSK的达普司他在美国和日本两地上市、康哲药业的德度司他在印度获批上市。
纵观全球HIF-PHI药物市场,日本是获批上市最多的国家。但是和罗沙司他一样,由于安全性问题,Akebia Therapeutics 的伐达度司他虽然已经在日本上市,其在美国的上市申请也遭到FDA拒绝,成为了第二款被FDA拒之门外的HIF-PHI药物,可见,FDA监管层对于HIF-PHI药物安全性的重视。
虽然HIF-PHI药物闯关FDA接连失败,2023年2月1日,随着GSK的达普司他在美国获批上市,用于至少接受4个月透析的成人慢性肾病(CKD)贫血(红细胞数量减少)患者的治疗,成为FDA批准的首 个在美国获批上市的首 个HIF-PHI类药物,至此,HIF-PHI药物的FDA困局破解。
回归国内市场,目前已在国内上市的HIF-PHI 药物仅有阿斯利康/珐博进的罗沙司他,独占鳌头。
在研药物中,信立泰的恩那司他,目前处于上市申请阶段;康哲药业的德度司他处于III期临床试验阶段,三生制药的HIF-117处于II期临床试验阶段,恒瑞医药DDO-3055、东阳光药业HEC-53856 均处于I期临床阶段。
值得一提的是,进度最快的为信立泰的恩那司他2020年9月已在日本上市,2019年12月,信立泰从日本烟草公司(JT)引进了恩那司他,并以2250万美元首付款+最高 6500 万美元研发注册里程碑付款+销售里程碑款和一定比例的销售分成获得了该药在中国市场肾性贫血领域的独家技术开发、生产、市场销售及商业化权益,2022年1月,信立泰提交了肾性贫血新药恩那司他片的上市申请并获CDE受理,目前还在申报上市阶段,有望成为罗沙司他之后第二款上市的HIF-PHI 药物。
结 语
总之,当前HIF-PHI 药物领域不管是上市药品还是在研产品,赛道尚不拥挤,但是不断攀升的销售额以及广阔的市场前景使得各家药企纷纷布局HIF-PHI 创新药研发,如今随着罗沙司他仿制药的竞相报产,战火从创新药赛道烧到了仿制药赛道,竞争将愈演愈烈。
参考资料:
[1]《正大天晴首家报产这个“国内唯一药物”,去年卖出15亿元》药春秋,2022年5月22日
[2]《FDA 首次批准 HIF-PHI 类药物上市,国内多款在研药物开发加速》安信证券,2023年2月5日



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57