7月17日,礼来在阿尔茨海默病协会国际会议(AAIC)上公布了阿尔茨海默病治疗药物——Donanemab的三期临床试验结果:Donanemab对处于疾病早期阶段的试验参与者更有益,与安慰剂受试者相比,接受Donanemab治疗的受试者认知和功能的下降减缓了60%,临床痴呆评定量表(CDR-SB)显示,患者认知能力衰退减缓了46%。
随着全球老龄化的加剧,阿尔茨海默病(AD)药物需求巨增,然而AD药物开发曲折而漫长,无数药企经过多次尝试仍无功而返,如礼来、罗氏和辉瑞等……
AD的发病机制至今仍未破译,其中β淀粉样蛋白(amyloid-β,Aβ)的生成、清除失衡和Tau蛋白过度磷酸化导致炎症反应、神经元死亡等一系列病理过程是目前比较公认的AD发病机制。
AD药物类型多样,包括疫苗、单抗和小分子抑制剂等。目前还没有AD疫苗被FDA或NMPA批准上市,但是有很多在临床开发阶段,包括CAD-106、ABvac40、ACl-24.060和ACI-35.030等。
AD单抗Aducanumab和Lecanemab都获得了FDA的加速批准,然而Aducanumab的上市饱受争议,FDA专家委员会成员愤然辞职以及美国医保拒绝支付等因素导致Aducanumab销售额远不达预期,上市的前四个月销售额不足200万美元。
Lecanemab于今年1月份获加速批准上市,不同于Aducanumab,Lecanemab有明确的临床效果,最终于7月6号获得了FDA完全批准,成为了20年来首 款获得FDA完全批准的AD新疗法,开启了其真正的商业化道路。
近期礼来公布了其Donanemab3期临床试验的完整结果:与安慰剂相比,其认知与功能下降减缓达60%。
好消息接踵而来,AD患者看到了曙光,除了已上市的AD药物之外,还有哪些在研的AD药物呢?这些同行者能否紧追其上,后续发力成功上市,造福患者呢?
未全破译的发病机制
阿尔茨海默病(Alzheimer ′s disease,AD)是老年期痴呆最常见的一种类型,以进行性发展的神经系统变性为特征,是导致老年人失能的重要原因。
据国际阿尔茨海默病协会(ADI)发布的《世界阿尔茨海默病2018年报告》显示,目前全世界至少有5000万名痴呆患者,到2050年预计将达到1.52亿。据估计,中国的阿尔茨海默病患病率很高,其次是美国和日本。仅在美国,每年就有大约900,000名新患者被诊断出来。阿尔茨海默病患病率的增加,正在推动全球阿尔茨海默病治疗市场的增长。
AD的发病机制复杂,至今仍未完全破译具体机制。AD的发病机制与β淀粉样蛋白 ( amyloid-β,Aβ)沉积、tau蛋白神经纤维缠结、神经炎性机制学说、神经血管受损学说、氧化应激等密切相关。目前比较公认的AD发病机制是Aβ的生成和清除失衡导致神经元变性和痴呆发生,其可诱导Tau蛋白过度磷酸化、炎症反应、神经元死亡等一系列病理过程(图1)[1]。
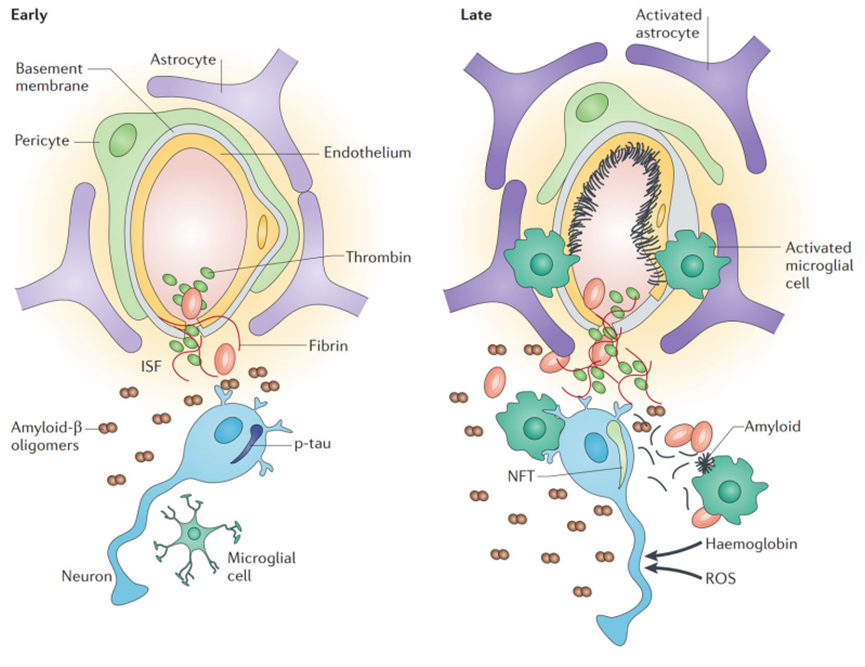
图1. 阿尔茨海默病血管损伤模型
在阿尔茨海默病早期阶段,血脑屏障(BBB)功能障碍导致淀粉样蛋白β清除错误,以及神经毒 性淀粉样蛋白β低聚物在组织液(ISF)中的积累、微出血和毒 性血液来源分子(即凝血酶和纤维蛋白)的积累,从而影响突触和神经元功能。
过度磷酸化的tau(p-tau)在神经元中积累,以响应灌注不足和/或淀粉样蛋白β水平升高。此时,小胶质细胞开始感知神经元损伤。在脑毛细血管疾病的后期阶段,微血管变性导致基底膜蛋白和血管周围淀粉样蛋白的沉积增加。
沉积的蛋白质和淀粉样蛋白阻碍毛细血管血流,导致外排泵失败,代谢废物积聚,pH和电解质组成发生改变,随后突触和神经元功能障碍。神经原纤维缠结 (NFT) 会因缺血性损伤和淀粉样蛋白β水平升高而积累。小胶质细胞和星形胶质细胞的活化与明显的炎症反应有关。
AD药物的开发是漫长而曲折的,无数的企业无功而返,它们开发的药物因达不到临床终点而被终止,如诺华、安进和班纳的BACE1抑制剂umibecestat(CNP520)、罗氏的crenezumab和gantenerumab、礼来的semagacestat、solanezumab以及lanabecestat、辉瑞与强生的bapineuzumab以及强生的atabecestat等。
AD药物类型多样,包括小分子药、疫苗和抗体等,下文主要为大家介绍AD药物的研发进展。
疫苗研发进展
AD药物治疗策略之一是预防性疫苗,这类疫苗旨在激发人体免疫系统对Aβ或Tau的免疫反应,从而帮助清除Aβ或Tau,减少它们的沉积,延缓阿尔茨海默病的进展。
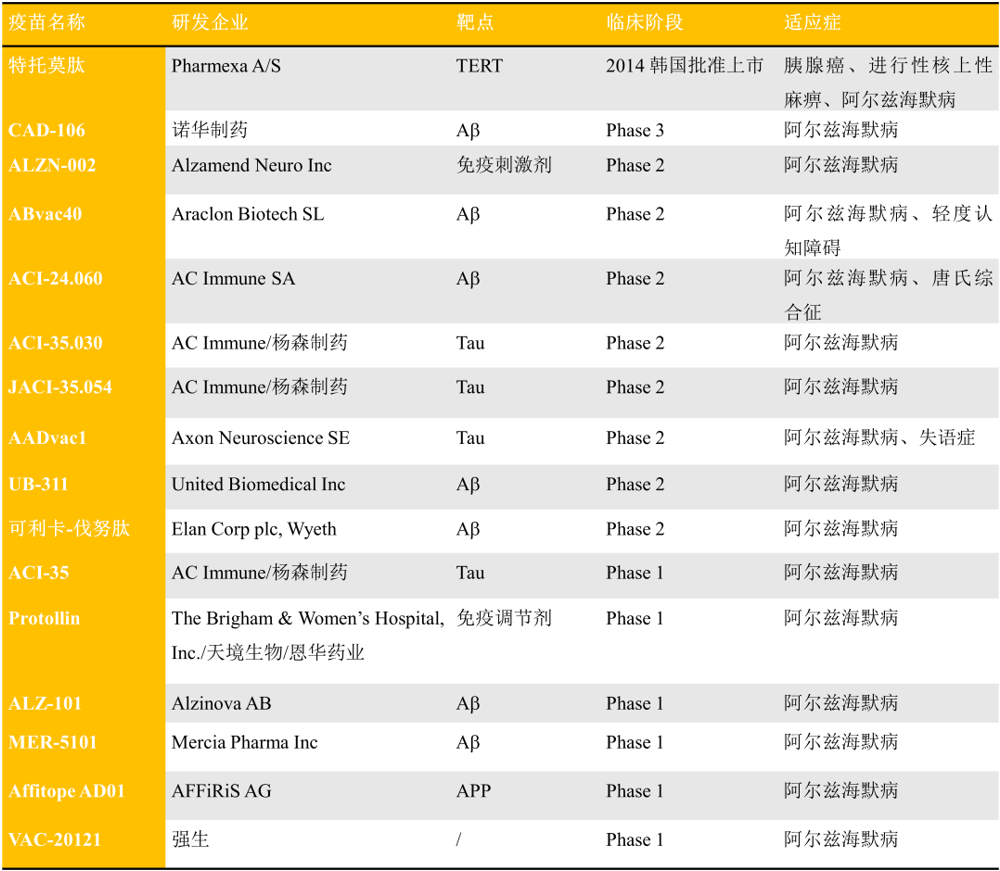
除了曾在韩国上市的特托莫肽用作AD疫苗之外,目前还没有AD疫苗被FDA或NMPA批准上市,但是有很多在临床开发阶段,包括amilomotide(CAD-106)、ALZN-002、ABvac40、ACl-24.060和ACI-35.030等(表1)。
表1. 部分临床在研的AD疫苗
Amilomotide
Amilomotide(CAD-106)是诺华开发的一款Aβ疫苗,之前一项2b期双盲安慰剂对照试验结果显示:150 μg剂量组有55.1%受试者产生Aβ免疫球蛋白,450 μg剂量组这一比例为81.1%,获得积极结果,但是目前没有新的进展报道[2]。
ABvac40
是由Araclon Biotech公司开发的一款多肽疫苗,它表达Aβ40片段的C端序列,去年的一项2期临床试验结果显示:接种6剂ABvac40导致抗Aβ40特异性抗体水平的显著升高,安全性方面,ABvac40和安慰剂之间没有显著的区别。
ACI-24.060
是AC Immune基于SupraAntigen平台开发的一款靶向Aβ的疫苗,今年1月份,该公司宣布ACI-24.060获得FDA突破性疗法资格认定,受此消息影响,当天该公司股价大涨71.72%,近期,AC Immune又获得了FDA快速通道指定。
ACI-35.030
是AC Immune和杨森合作开发的一款抗磷酸化Tau(pTau)候选疫苗,去年11月30日,AC Immune宣布ACI-35.030已被选中进一步开发。
2022年,阿尔茨海默病临床试验(CTAD)会议上报道了ACI-35.030的1b/2a期试验的新临床数据:ACI-35.030治疗迅速诱导tau病理蛋白(如pTau及其聚集形式ePHF)的特异性抗体。ACI-35.030诱导的抗体反应持续存在,并且可以在72周内定期增强。候选疫苗总体耐受性良好。选择ACI-35.030的决定是在CTAD上提出的比较之后做出的,该比较显示了其相对于蛋白质结合疫苗JACI-35.054的优势。JACI-35.054是一种替代抗pTau疫苗,也在1b/2期试验中并行评估[3]。
抗体和小分子药物
近年来,只有卫材/Biogen靶向Aβ的两款AD单抗新药Aducanumab和Lecanemab获得了FDA的批准,而国内只有九期一被批准上市并被纳入医保,但是Aducanumab和九期一都备受争议,没有得到大众的广泛认可。
已上市药物
饱受争议的Aducanumab和九期一
Aducanumab的加速批准引起了强烈的争议,3名FDA专家委员会成员愤然辞职,美国众议院、联邦监察机构也先后对FDA进行问询或采取审查行动,要求其进一步对Aducanumab的研究数据进行解释。Aducanumab也没有得到医保的支持,基于种种原因,Aducanumab上市后表现并不理想,前4个月销售额不足200万美元。
九期一于2019年被NMPA批准上市,然而自上市以来争议不断,销售额也越来越不理想,虽然进医保后价格大幅下降,但因患者看不到疗效,以及国际多中心3期临床研究被提前终止等原因销售额逐渐下降。
已上市药物
20年来首 款——Lecanemab
Lecanemab(商品名:Leqembi)是由卫材/渤健联合开发的人源化的与Aβ可溶性原纤维高亲和力结合的IgG1单克隆抗体,今年1月6日,FDA通过加速批准途径批准了lecanemab用于治疗AD。FDA于7月6日完全批准lecanemab用于治疗AD,使得lecanemab成为了20年来首 款获得FDA完全批准的AD新疗法,这一转变有重大意义,因为这意味着Lecanemab的商业化进程将正式起步。Lecanemab的完全上市占有时间优势,至于能否完全抢占市场先机,则需要取决于临床数据能否支持其在更多国家获批上市。
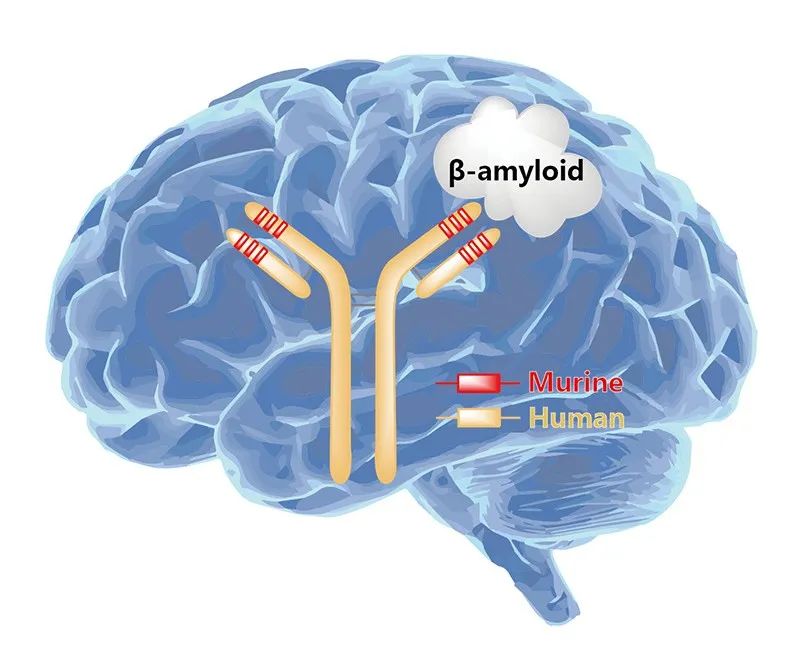
图2. Lecanemab作用示意图,来源:药渡数据
此次申请是基于验证性3期Clarity AD研究的积极结果,试验达到了主要终点和所有关键次要终点,且结果具有高度统计学意义。但是也存在安全性问题,接受该药物治疗17.3%的患者出现了脑出血(安慰剂对照组为9%),12.6%的患者出现了脑肿胀(安慰剂对照组为1.7%),这也让Lecanemab在如今完全获批上市后,实际商业扩展能否顺利存在一定的不确定性。
去年12月份,Lecanemab在中国的上市申请获CDE受理。今年2月28日,卫材中国宣布,该药被NMPA纳入优先审评和批准程序,预计将缩短审评时间。
除了已上市的产品,目前进展最快的几款药物包括礼来的Donanemab和Remternetug、Annovis Bio的Buntanetap、勃林格殷格翰的Iclepertin、阿斯利康/ Cerveau Technologies 的Flutafuranol (18F)、Xigen SA的Brimapitide和Alzheon的Valitramiprosate(ALZ-801)等(表2)。
表2. 部分临床在研的AD抗体和小分子药物
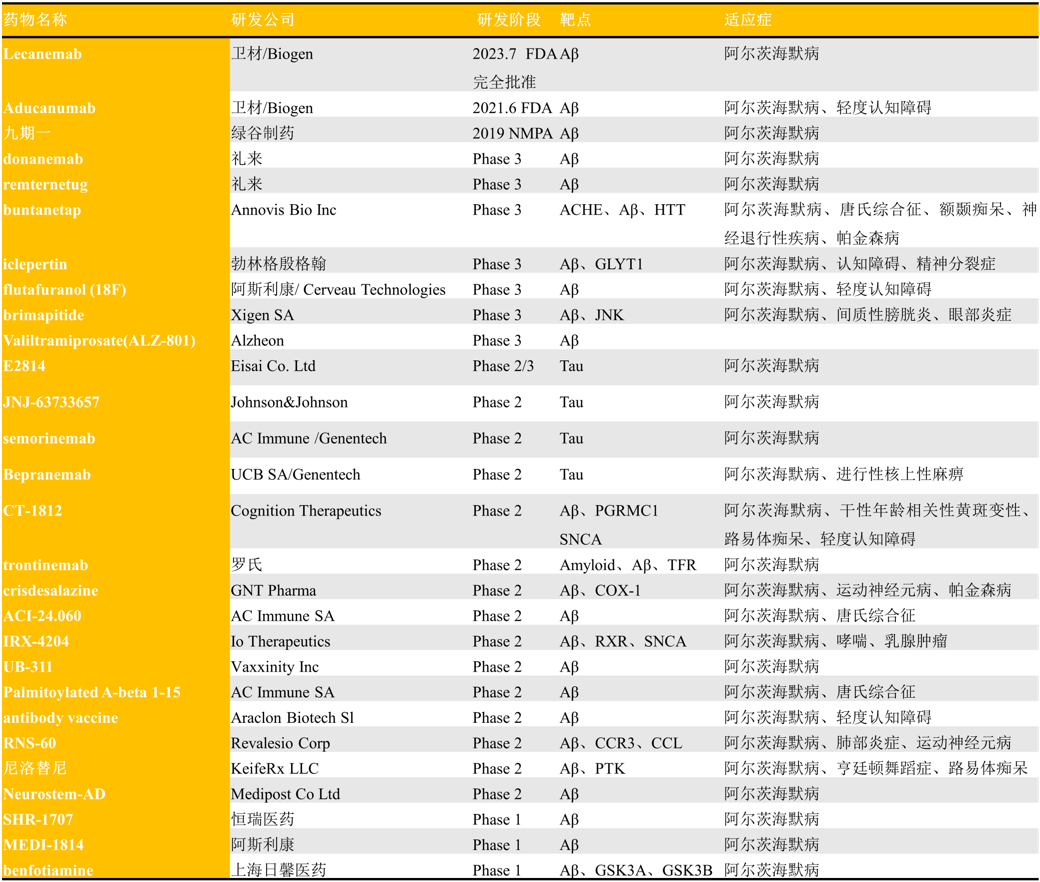
在研药物
Donanemab
Donanemab是Lecanemab的一大强劲对手,近期,礼来公布了donanemab在3期临床试验TRAILBLAZER-ALZ 2中的完整结果:亚群分析显示,处于疾病最早阶段的受试者获益更为显著,与安慰剂相比,其认知与功能下降减缓达60%。
Donanemab的优势是注射间隔更长,每四周注射一次,Lecanemab是两周一次注射,患者负担更大,是显著劣势。但另一方面,安全性问题上Donanemab可能会处于劣势,Donanemab的淀粉样蛋白相关成像异常(ARIA)的发生率为1.6%,其中包括两名因ARIA死亡的参与者和一名在严重ARIA事件后死亡的参与者。
今年第二季度,礼来已完成向FDA递交上市申请,并预计在今年年底获得审评结果,在上市时间上,Lecanemab占有很大的优势,今年已经获得完全批准上市,期待后续商业化表现。与此同时,Donanemab于今年6月27日首次在国内获批临床。
在研药物
Remternetug
Remternetug(LY3372993)是由礼来开发的下一代N3pG淀粉样蛋白(一种修饰的b样淀粉蛋白)抗体,靶向名为N3pG的淀粉样蛋白亚型,可以采用皮下给药等灵活的给药方式。今年2月份,礼来启动了remternetug注射液治疗早期阿尔茨海默病患者的3期临床试验。
在研药物
Buntanetap
Buntanetap(ANVS401)是由Annovis公司研发的一种口服脂质小分子药物,是一种神经毒 性聚集蛋白的翻译抑制剂,可每天一次给药,其独特的作用机制使其能够同时抑制多种神经毒 性蛋白。
图3. Buntanetap结构式,来源:药渡数据
今年6月份,数据和安全监查委员会(DSMB)对Buntanetap的3期试验进行了积极的安全审查,发现Buntanetap无药物相关严重不良事件(SAE),单个不良事件发生率小于2%。
在研药物
JNJ63733657
是由强生开发的一款抗Tau单抗药物,目前处于临床2期,2021年8月JNJ63733657在国内申报临床。
在研药物
SHR-1707
是由恒瑞医药研发的抗Aβ单克隆抗体,今年3月份恒瑞宣布用于治疗早期AD的Ib期临床试验在中国科学技术大学附属第一医院完成了首例患者入组及给药。
小 结
人口老龄化带来的全球患病人数的增加,使得人们对阿尔兹海默症药物的需求越来越多,然而关于阿尔兹海默症发病机制尚不明确。虽然AD药物类型多样,包括疫苗、单抗和小分子抑制剂等。但AD药物开发曲折而漫长,除了Aducanumab和Lecanemab获FDA批准上市之外,其它药物类型还尚无被FDA批准上市的。
只有Lecanemab于今年7月6号获FDA完全批准上市,成为20年来首 款获FDA完全批准的AD药物,但是它也存在安全性问题,后续能否成功开启商业化道路还需要更多时间考察。不仅如此,Lecanemab还有Donanemab这个强劲的对手。
AD药物市场巨大,很多国内外药企前仆后继加入布局,包括礼来、罗氏、辉瑞等,国内也有很多企业从事阿尔兹海默症药物开发,如恒瑞医药、绿谷制药、通化金马、康弘药业、新华制药、海正药业、步长制药和石药集团等。
参考资料:
1.Berislav V. Zlokovic, Neurovascular pathways to neurodegeneration in Alzheimer’s disease and other disorders, Nat Rev Neurosci. ; 12(12): 723–738.
2.Rik Vandenberghe, Marie-Emmanuelle Riviere, et.al, Active Aβ immunotherapy CAD106 in Alzheimer's disease: A phase 2b study, Alzheimers Dement (N Y). 2016" Dec 23;3(1):10-22.
3.AC Immune’s Alzheimer’s Disease Vaccine-candidate ACI-35.030 Selected for Further Development | AC Immune SA



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57