1、光动力治疗概述
光动力疗法(PDT)是20世纪开始的一种治疗方法,使用适当波长的光照射光敏剂杀伤病灶部位细胞,可以选择性地对体内的癌细胞造成损害。自古以来,PDT广泛用于治疗各种疾病,如牛皮癣、白癜风或皮肤癌。这种治疗方式可以追溯到3000多年前,古印度人和埃及人就开始使用天然植物(主要利用补骨脂素)治疗各种皮肤病[1, 2]。目前,它已经被应用于治疗头颈部粘膜、乳腺、前列腺、膀胱、子宫颈和皮肤癌等疾病[3, 4]。
近年来,PDT广泛应用于治疗一些浅表皮肤类临床疾病,逐渐成为一种很有前途的癌症治疗策略[5]。PDT的实体肿瘤治疗临床应用方案如图1-1所示,PDT是通过局部或静脉注射光敏剂,当光敏剂聚集在肿瘤组织中后,肿瘤组织暴露在适当波长光辐照下(通常在红色光谱区域,λ≥600 nm),就会在光照射的组织部位产生ROS,达到肿瘤治疗的效果。与其他传统疗法相比,PDT具有微创性、无全身毒性和患者生活质量高等突出优点[6]。
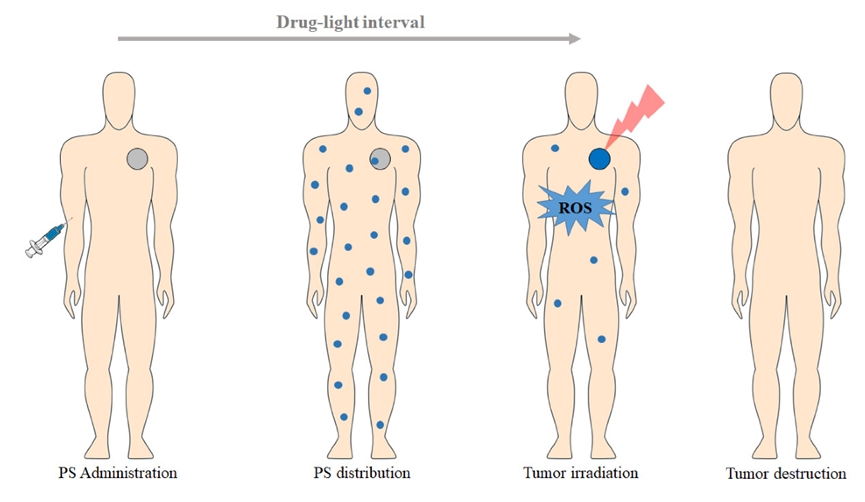
图1-1 在实体肿瘤治疗中的PDT临床应用方案[7]。
2、影响光动力治疗的关键因素
受限于光源的穿透深度和肿瘤乏氧微环境,激发光源和氧气成为了影响PDT疗效的关键因素。
在PDT中,激发光敏剂的光的波长决定了照射组织的穿透深度。可用于PDT的大多数光敏剂易于被生物组织穿透力弱的短波紫外或可见光激发[8],导致PDT仅限于治疗浅表组织的疾病[9]。近红外光(NIR)与常规PDT治疗用的紫外或可见光相比,NIR触发的PDT对病变区域的组织穿透性更深并且对正常组织光损伤更低,对于体内深层组织处肿瘤的治疗具有更大潜力。自发光包括化学发光和生物发光,同样可以作为PDT光源。自发光过程中,化学或生物能量可以转化为光,能够在没有外部光源的情况下触发PDT。这意味着使用自发光不需考虑激发光源组织穿透深度有限的问题。
氧气是PDT中产生多种ROS的反应底物。充足的氧气供应是保证PDT效果的前提。深层组织处肿瘤氧气含量低,肿瘤组织的缺氧微环境可以促进肿瘤生长和转移,解决肿瘤微环境缺氧是PDT的一大挑战。原位产生氧气是解决实体瘤缺氧最常用的方法。研究者们通常使用催化剂催化细胞内H2O2分解成氧气和水,可以实现原位自供氧。肿瘤中H2O2的水平始终很高,多种催化剂均可以催化H2O2分解产生氧气。过氧化氢酶(CAT)由于具有很高催化效率,成为最常用的催化剂之一。向肿瘤输送外源性氧气是为缺氧的肿瘤环境补充氧气的另一种常用的方法。目前,研究较多的氧载体有全氟碳化物(PFCs)和血红蛋白(Hb)。PFCs具有高氧容量,由于物理力介导的吸附,溶解在PFCs中的氧量与氧张力和温度有关。因为PFCs中氧气的溶解度远高于血液中氧气的溶解度,PFCs可以解决PDT过程中缺氧和氧气消耗的问题,有利于促进ROS产生[10]。
3、长余辉纳米材料
长余辉材料又叫做持久发光材料,可以存储来自紫外光、可见光、X-射线或其他激发源的能量,然后发射光子逐渐释放能量[11]。长余辉发光是一种独特的光学过程,在激发辐射停止后,长余辉材料会发出持久的余辉。与依赖于实时激发的荧光相比,余辉是由于存储在长余辉材料能量阱中激发能量的热刺激和延迟释放。因此,它可以持续数秒、数小时甚至是数天。
2007年,首次将长余辉材料制备成纳米粒子,并用小动物活体成像[12]。长余辉纳米粒子(PLNP)可以在进入生物系统中之前预储存能量,从而避免由激发光引起的自发荧光或背景散射光的干扰。通过尺寸调节、发射调节以及表面改性,PLNP作为新一代先进光学材料,已广泛用于生物传感、生物成像和成像引导治疗的研究[13]。
4、长余辉纳米材料的生物医学应用
4.1 生物传感
PLNP的激发和发射在时间上是分离的,PLNP可以在储存能量后持续发光很长时间,因此,PLNP可以避免自发荧光的干扰。2011年,Wu等人制备了一种水溶性功能化PLNP(Ca1.86Mg0.14ZnSi2O7:Eu2+:Dy3+,Eu2+),通过荧光共振能量转移(FRET)抑制实验对α-甲胎蛋白(AFP)进行检测。在PLNP表面包覆一层聚乙烯亚胺,然后与甲胎蛋白抗体包被的金纳米颗粒偶联。Au纳米颗粒由于具有较高的摩尔吸附系数而被用作猝灭剂。这种高灵敏度和高特异性的持久光致发光探针可以检测血清样本中的AFP,并实时成像癌细胞生长过程中排出的AFP[14]。
4.2 生物成像
无需连续原位激发的PLNP可以有效地消除生物成像中动物组织的背景自发荧光,从而显著提高成像灵敏度和信噪比。由于PLNP具有很大的比表面积,可以通过二氧化硅包覆、聚合物连接、生物分子偶联等方法实现表面修饰,修饰之后PLNP可以广泛应用于生物成像领域。PLNP首先被Scherman等人用于活体成像[15]。与传统的体内光学成像探针相比,PLNP具有高的光稳定性、优异的信噪比和良好的生物相容性,可以直接用于商业成像系统。长余辉发光的可重复激发能力使PLNP可以用于长期的活体生物成像[16]。
4.3 光动力治疗
大多数用于PDT的光敏剂需要长时间通过紫外或可见光连续激活,这类光源组织穿透深度有限,辐射还会引起过热和细胞损伤。具有持久NIR光发射的PLNP无需连续光子激发,可以作为激活PDT的持久光源[17]。这一特征有望最大限度地减少PDT有害副作用,并实现无需持续外部照射这种方便的临床癌症治疗方式[18]。
Abdurahman等人报道了硅酞菁光敏剂(Si-Pc)与808 nm近红外光共轭的PLNP体系,用于可再生NIR光致发光的PDT[19]。Huang等人构建了可注射的长余辉(PL)植入物,作为一种高效可重复的PDT内置激发光源。这项研究代表了基于PLNP的PDT新概念,有效抑制了肿瘤生长[20]。
5、总结与展望
光动力疗法(PDT)具有高时空选择性、微创性和低毒性的优点,是一种新型肿瘤治疗策略。激发光源和氧气是影响PDT的两大因素,常用光源的组织穿透能力有限,并且肿瘤微环境大多乏氧,限制了PDT的治疗效果。长余辉发光材料可以存储能量,在无激发光源的条件下可持续自行发光数分钟到数天。通过长余辉纳米粒子(PLNP)可控发光,可以实现无需外界光源激发的PDT。
长余辉纳米复合物,能够实现靶向识别癌细胞,响应癌细胞内高浓度谷胱甘肽(GSH)实现自供氧和自发光的PDT。纳米复合物可以在GSH过表达的肿瘤细胞中启动PDT,并以自发光和自供氧的方式完成,从而在没有外界光照射的情况下在体内产生显著的肿瘤抑制作用,为肿瘤PDT的研究提供一个新的方法。后续研究中可以对长余辉纳米复合物在癌细胞内的生物学效应进行进一步研究。例如:PDT能激活宿主抗肿瘤免疫反应,但不足以阻止肿瘤转移。可以在PDT基础上继续研究由PDT引发的自体免疫反应,在长余辉纳米复合物的材料体系基础上,引入吲哚胺2,3-双加氧酶(IDO)抑制剂,增强PDT后的免疫激活效力,实现光动力免疫联合治疗,防止癌症复发。
参考文献
[1] Ackroyd R, Kelty C, Brown N, et al. The history of photodetection and photodynamic therapy[J]. Photochemistry and Photobiology, 2001, 74(5): 656-669.
[2] Mitton D, Ackroyd R. A brief overview of photodynamic therapy in europe[J]. Photodiagnosis and Photodynamic Therapy, 2008, 5(2): 103-111.
[3] Zhang J, Tian Q, Zhang M, et al. Immune-related biomarkers in triple-negative breast cancer[J]. Breast Cancer, 2021, 28(4): 792-805.
[4] Kawczyk-Krupka A, Bugaj A M, Latos W, et al. Photodynamic therapy in colorectal cancer treatment-the state of the art in preclinical research[J]. Photodiagnosis and Photodynamic Therapy, 2016, 13: 158-174.
[5] Zhu Z, Tang Z W, Phillips J A, et al. Regulation of singlet oxygen generation using single-walled carbon nanotubes[J]. Journal of the American Chemical Society, 2008, 130(33): 10856-10857.
[6] Allison R R, Bagnato V S, Sibata C H. Future of oncologic photodynamic therapy[J]. Future Oncology, 2010, 6(6): 929-940.
[7] Correia J H, Rodrigues J A, Pimenta S, et al. Photodynamic therapy review: Principles, photosensitizers, applications, and future directions[J]. Pharmaceutics, 2021, 13(9): 1332.
[8] Weissleder R. A clearer vision for in vivo imaging[J]. Nature Biotechnology, 2001, 19(4): 316-317.
[9] Simmons B J, Griffith R D, Falto-Aizpurua L A, et al. An update on photodynamic therapies in the treatment of onychomycosis[J]. Journal of the European Academy of Dermatology and Venereology, 2015, 29(7): 1275-1279.
[10] Spahn D R. Blood substitutes artificial oxygen carriers: Perfluorocarbon emulsions[J]. Critical Care, 1999, 3(5): R93-R97.
[11] Maldiney T, Bessiere A, Seguin J, et al. The in vivo activation of persistent nanophosphors for optical imaging of vascularization, tumours and grafted cells[J]. Nature Materials, 2014, 13(4): 418-426.
[12] De Chermont Q L, Chaneac C, Seguin J, et al. Nanoprobes with near-infrared persistent luminescence for in vivo imaging[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(22): 9266-9271.
[13] Wu S Q, Chi C W, Yang C X, et al. Penetrating peptide-bioconjugated persistent nanophosphors for long-term tracking of adipose-derived stem cells with superior signal-to-noise ratio[J]. Analytical Chemistry, 2016, 88(7): 4114-4121.
[14] Wu B-Y, Wang H-F, Chen J-T, et al. Fluorescence resonance energy transfer inhibition assay for alpha-fetoprotein excreted during cancer cell growth using functionalized persistent luminescence nanoparticles[J]. Journal of the American Chemical Society, 2011, 133(4): 686-688.
[15] De Chermont Q L M, Chaneac C, Seguin J, et al. Nanoprobes with near-infrared persistent luminescence for in vivo imaging[J]. Human Gene Therapy, 2007, 18(10): 1058-1058.
[16] Zhang D D, Liu J M, Sun S M, et al. Construction of persistent luminescence-plastic antibody hybrid nanoprobe for in vivo recognition and clearance of pesticide using background-free nanobioimaging[J]. Journal of Agricultural and Food Chemistry, 2019, 67(24): 6874-6883.
[17] Sun S K, Wu J C, Wang H, et al. Turning solid into gel for high-efficient persistent luminescence-sensitized photodynamic therapy[J]. Biomaterials, 2019, 218: 119328.
[18] Ozdemir T, Lu Y-C, Kolemen S, et al. Generation of singlet oxygen by persistent luminescent nanoparticle-photosensitizer conjugates: A proof of principle for photodynamic therapy without light[J]. Chemphotochem, 2017, 1(5): 183-187.
[19] Abdurahman R, Yang C-X, Yan X-P. Conjugation of a photosensitizer to near infrared light renewable persistent luminescence nanoparticles for photodynamic therapy[J]. Chemical Communications, 2016, 52(90): 13303-13306.
[20] Fan W, Lu N, Xu C, et al. Enhanced afterglow performance of persistent luminescence implants for efficient repeatable photodynamic therapy[J]. Acs Nano, 2017, 11(6): 5864-5872.
作者简介:@LLH,食品科学专业硕士,研究方向为核酸生物功能材料用于恶性肿瘤诊断治疗,一名刚刚踏上制药道路的职场小 白。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57