导读:
自1940 年代以来,治疗传染病的抗生素的发现对人类和动物健康产生了巨大影响。然而,抗生素和消毒剂的随意使用在世界范围内导致了前所未有的健康问题。这种情况起源于微生物开始产生对残留抗生素产生抗性的基因。耐药基因增强了病原体在多种环境中的存活率,这不仅限制了传染病的治疗选择,而且通过在人和动物中传播多种耐药细菌而增加了发病率和死亡率。
据推测,到 2050 年,耐药微生物造成的人类死亡人数可能会从每年约700000人增加到每年 1000 万人(世界卫生组织,2014 年)。死亡人数的增加,并没有引起更多人关注抗生素的研发,由于利润偏低和研发热情的减退,抗生素的研发陷入了一种困境。科学家们正寻找对策应对这一重大的卫生健康挑战。
正文:
以青霉素为代表的抗生素,挽救了无数的生命,为人类的健康作出了巨大的贡献。但随着抗生素的耐药性越来越严重,可用的抗生素也变得越来越少。现今人类还在使用的抗生素大概100多种,而由于利润较低等原因,新研发的抗生素数量并不多,呈现青黄不接的状态。
近年上市比较有名的抗生素,可以追溯到2018年10月,美国FDA批准的甲苯磺酸奥马环素。甲苯磺酸奥马环素是一种新型四环素,每天用药一次,有口服与静脉注射(IV)两种剂型。这一灵活的给药方式将有助于减少潜在的、住院带来的感染风险。甲苯磺酸奥马环素旨在克服四环素耐药性,并具有广谱抗菌活性,包括革兰阳性菌、革兰阴性菌、非典型病原体和多种耐药菌株。
合成科学家已经合成了数量庞大的合成分子数据库,数量数以百万计。如何从如此数量庞大的合成分子数据库中筛选出合适的抗生素,成为了一个比较有挑战性的问题。借助AI加速合成分子的筛选,从而助力抗生素的研发,越来越引起大家的注意。
2023年12月20日,美国麻省理工学院James Collins教授团队在国际顶 尖学术期刊《自然》上发表了题为《Discovery of a structural class of antibiotics with explainable deep learning》的研究[1]。James Collins教授等推断,与抗生素活性相关的化学子结构可以用于预测抗生素的结构类别。通过开发一种基于化学子结构的方法来验证这一假设,该团队确定了39312 种化合物的抗生素活性和细胞毒性特征,并应用AI预测超过1200万种化合物的抗生素活性和细胞毒性。同时,团队通过实验测试了283 种化合物,发现对金黄色葡萄球菌表现出抗生素活性的化合物符合上述的化学子结构规律。在这些结构类别的化合物中,其中一种化合物对耐甲氧西林金黄色葡萄球菌 (MRSA) 和耐万古霉素肠球菌具有选择性。该研究表明,AI在新药研发中具有非常大的潜力。
来自杜克大学的研究人员Pei Zhou等提出了一种新型抗生素-LpxC抑制剂 LPC-233[2]。该化合物是一种快速杀菌抗生素,不受已建立的商业抗生素耐药机制的影响,在体外对多种革兰氏阴性临床分离株具有出色的活性。它具有口服生物利用度,可有效消除小鼠软组织、败血症和尿路感染模型中易感和多重耐药革兰氏阴性细菌病原体引起的感染。它在体外和体内都显示出优异的安全性,在动物测试中没有可检测到的不良心血管毒性。这些结果确立了开发用于临床应用的口服LpxC靶向抗生素的可行性。
2023年8月22日,来自荷兰乌得勒支大学的Markus Weingarth和来自德国波恩大学的Tanja Schneider研究团队在Cell上发表题为An antibiotic from an uncultured bacterium binds to an immutable target的文章[3],发现了一种新型抗生素clovibactin。clovibactin是一种从未培养的土壤细菌中分离出来的抗生素,可有效杀死耐药革兰氏阳性细菌病原体,而没有检测到耐药性。使用生化分析、固态核磁共振和原子力显微镜,研究人员剖析了它的作用方式,机制上clovibactin可以通过靶向不同的关键前体分子来抑制细菌细胞壁的生物合成。
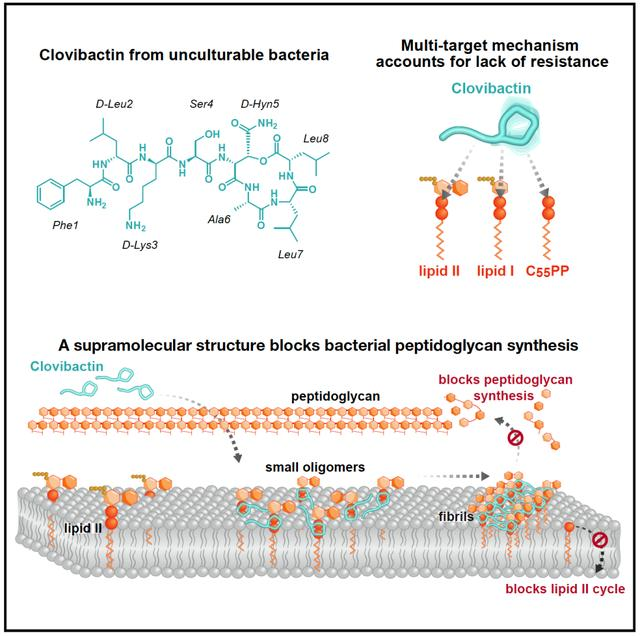
图1 clovibactin作用机制[3](图片来自网络)
由此上述例子可以看出,科学家在抗生素的研发路上并没有停止前进,而寻找不产生耐药性的抗生素,更是科学家们的终 极追求。
2020年6月9日,普林斯顿大学的一个研究小组在 Cell 杂志上发表报告称,他们发现了一种具有双机制的抗生素 SCH-79797[4],如一支 “带毒的箭” 刺穿细菌的细胞壁,靶向破坏细胞内的叶酸,且几乎不会产生耐药性。SCH-79797通过独特的双靶向作用机制 (MoA) 杀死革兰氏阴性菌和革兰氏阳性菌,在动物宿主模型中,SCH-79797 降低了鲍曼不动杆菌(一种耐药革兰氏阴性病原体)的发病机制。该研究表明,SCH-79797 具有两个独立的细胞靶点,即叶酸代谢和细菌膜完整性,并且在杀死 MRSA 持久性方面优于其它联合治疗。研究人员以SCH-79797的分子核心为基础,开发了具有增强功效的衍生物Irresistin-16,并在小鼠阴道感染模型中显示了其对淋病奈瑟氏球菌的功效。
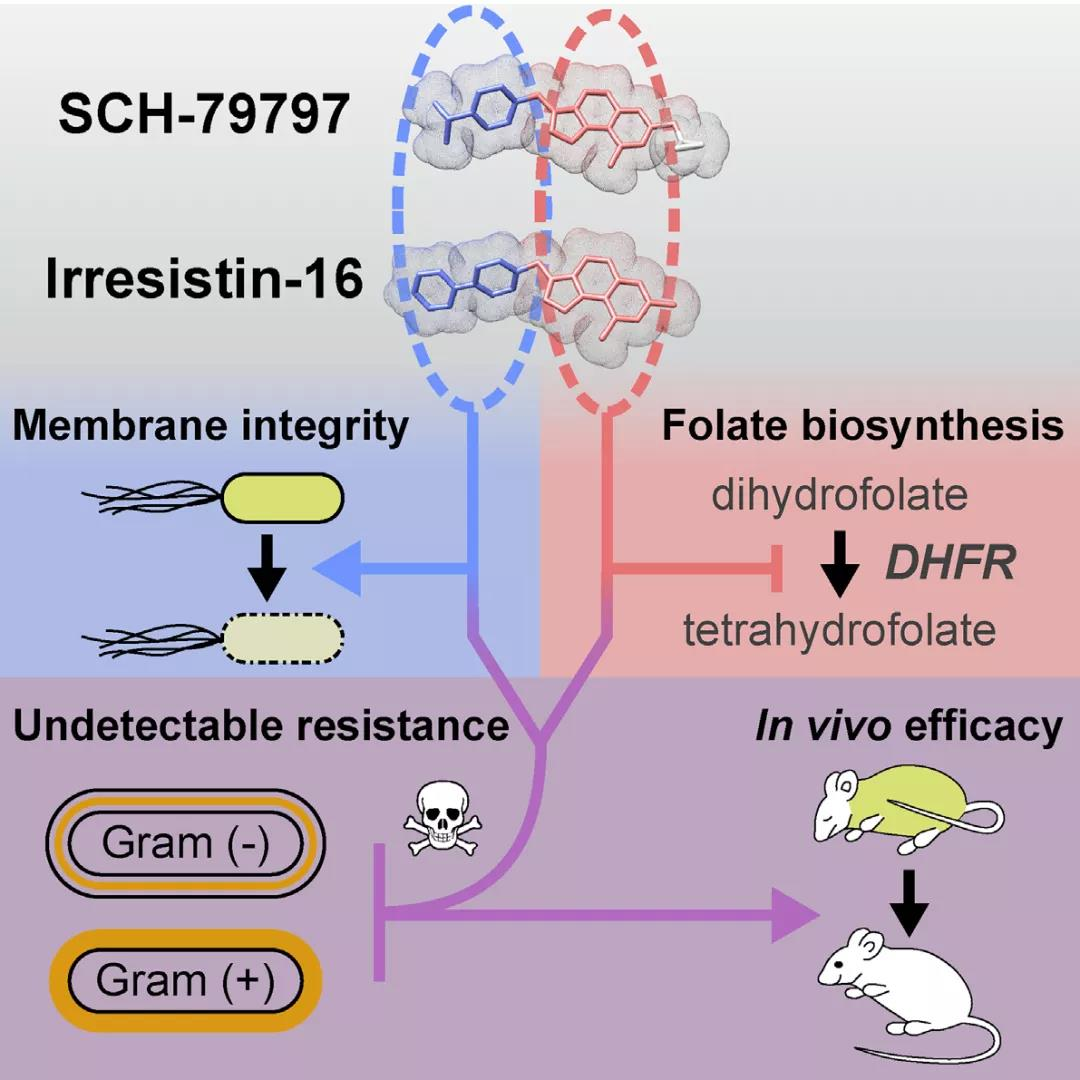
图2 SCH-79797的作用机制[4]
发展对人类和牲畜更安全且对传染性病原体有效的替代非抗生素策略也是新的方案。噬菌体的使用,抗菌肽(AMP)或细菌素、抗菌佐剂、粪便微生物群移植和通过转基因益生菌和后生元竞争性排除病原体是前瞻性的替代策略。在此背景下,还应开展研究,为细菌分泌系统和双组分系统等新的抑制分子寻找理想的靶点。细菌分泌系统是一种高度专业化的纳米机械系统,类似于“纳米注射器”,能够在真核细胞中直接递送物质。这使其成为纳米疗法和靶向药物递送系统非常理想的工具。
随着卫生当局、临床医生和药物开发商努力应对新出现的抗菌素耐药性危机,疫苗被认为是一种潜在的解决方案。免疫治疗是增强宿主免疫系统并赋予对传染性病原体免疫力的生物分子。使用最广泛的免疫治疗药物之一是聚乙二醇非格司亭,一种粒细胞集落刺激因子,它用于增加接受化疗的患者中性粒细胞计数严重下降。
值得注意的是,保持血液中适当的中性粒细胞计数很重要,这样免疫系统才能抵抗感染。类似的疗法也以聚乙二醇的形式用于动物。免疫治疗剂的优势在于它们可以增强内部免疫系统。
新的重组疫苗技术的发展有助于减少需要使用各种抗生素的原发性和继发性细菌感染。疫苗仍然是预防感染的最重要方法之一。一些针对致命致病菌的疫苗,例如艰难梭菌(III期)、结核分枝杆菌(II期)、B组链球菌(II期)、金黄色葡萄球菌(II期)正处于制药公司的中期临床开发阶段。
纳米颗粒材料既可用于输送抗菌物质,也可能含有抗菌物质。基于金属和金属氧化物的纳米颗粒和抗生素,由于毒性较小,抗菌、抗病毒和抗癌功效增强,被认为是未来在生物医学科学中应用的有前途的治疗候选药物。它们的大小为它们提供了独特的特性,例如增加的表面积与体积比,这使它们成为有效的药物载体,并增强了它们的溶解度、相容性和易于递送。纳米颗粒除了作为靶向药物递送的载体外,还可以通过多种机制具有自己的抗菌特性,例如破坏细菌壁,生物膜抑制,调节宿主免疫反应,产生活性氧以及损伤耐药细菌的关键DNA和蛋白质分子。由于这些不同的作用机制,纳米抗生素可能对抗生素耐药细菌有效。
文献详情:
1.Wong F, Zheng E J, Valeri J A, et al. Discovery of a structural class of antibiotics with explainable deep learning[J]. Nature, 2023: 1-9.https://doi.org/10.1038/s41586-023-06887-8.
2.Zhao J, Cochrane C S, Najeeb J, et al. Preclinical safety and efficacy characterization of an LpxC inhibitor against Gram-negative pathogens[J]. Science Translational Medicine, 2023, 15(708): eadf5668.DOI: 10.1126/scitranslmed.adf5668
3.Shukla R, Peoples A J, Ludwig K C, et al. An antibiotic from an uncultured bacterium binds to an immutable target[J]. Cell, 2023, 186(19): 4059-4073. e27.
4.Martin J K, Sheehan J P, Bratton B P, et al. A dual-mechanism antibiotic kills gram-negative bacteria and avoids drug resistance[J]. Cell, 2020, 181(7): 1518-1532. e14.
5.Kumar M, Sarma D K, Shubham S, et al. Futuristic non-antibiotic therapies to combat antibiotic resistance: A review[J]. Frontiers in microbiology, 2021, 12: 609459.
作者简介:roger,广东广州人,硕士研究生,工程师,主要研究方向为分析方法学,仪器原理与研制,凝聚态物理,电学理论与超导体理论,理论物理等等。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57