2023年FDA的新药审批有很多值得关注的特点。首先是CBER批准了17种新药,创下历史新高,而CDER也55款新药,接近21世纪的纪录(59款,2018年)。2023年是非同凡响的一年,对2024年的审批会有怎样前瞻性的指向?
1. 2023年的新药审批丰年
2023 年对于 FDA 新药和生物制剂审批而言是辉煌的一年,CDER与CBER总共批准了 72 种新药,这份成绩单不仅创下历史新高,而且将2018年的65款的纪录一下提高了7个(图1)。
CDER在 2023 年批准了 55 个新分子实体和新型治疗生物制剂,仅次于 2018 年的 59 个批准。本世纪CDER年度批准新药超过50种仅仅实现过四次,都发生在过去的六年内。
与CDER琴瑟和谐的是CBER,在蓬勃发展的再生医学和疫苗管道的推动下,CBER 2023 年批准了 17 种新型生物制品,实现了有史以来最大的新药批准总数。CBER此前的年度批准纪录是2015 年的12款。与2022年的CDER的37次批准和CBER的8项批准相比,2023年的确是一个丰年。
即便2022年的FDA批准有些"婉约",其批准数量也只是略低于15年平均值46.4个。而2023年的数量则比这个平均值高出25%以上。
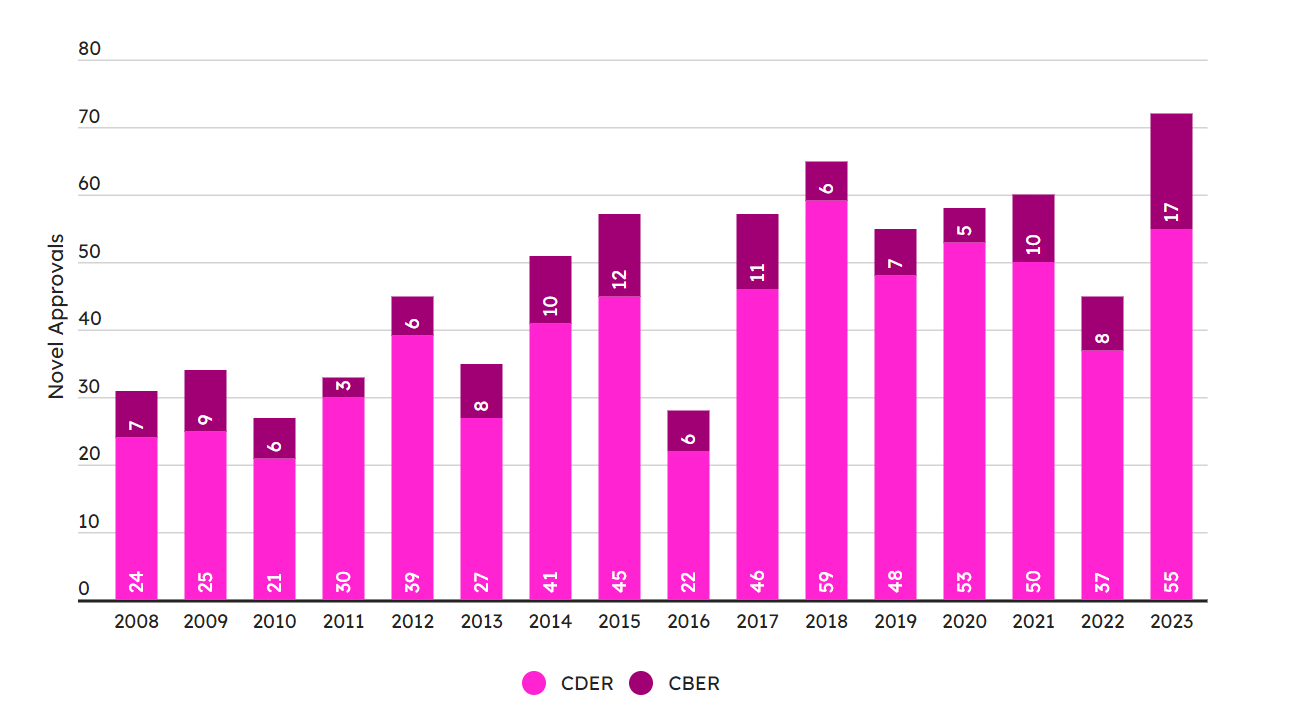
图1. FDA近15年批准新药数量。(图片来源:Pink Sheet)
2. 生物制剂持续走高
• 数量对比
生物制剂在2023年的新药中依然表现出强劲的态势。2021年,生物制剂的批准比例连续第三年保持在40%以上(图2)。72款获批新药中,新分子实体(NME)38款,生物制剂34个,几乎平分秋色。34款生物制剂中,有17中是CBER批准的(包括疫苗、细胞和基因治疗以及血液和血浆产品),17种来自于CDER的批准(包括单抗、酶替代疗法、双特异性抗体、寡核苷酸等)。
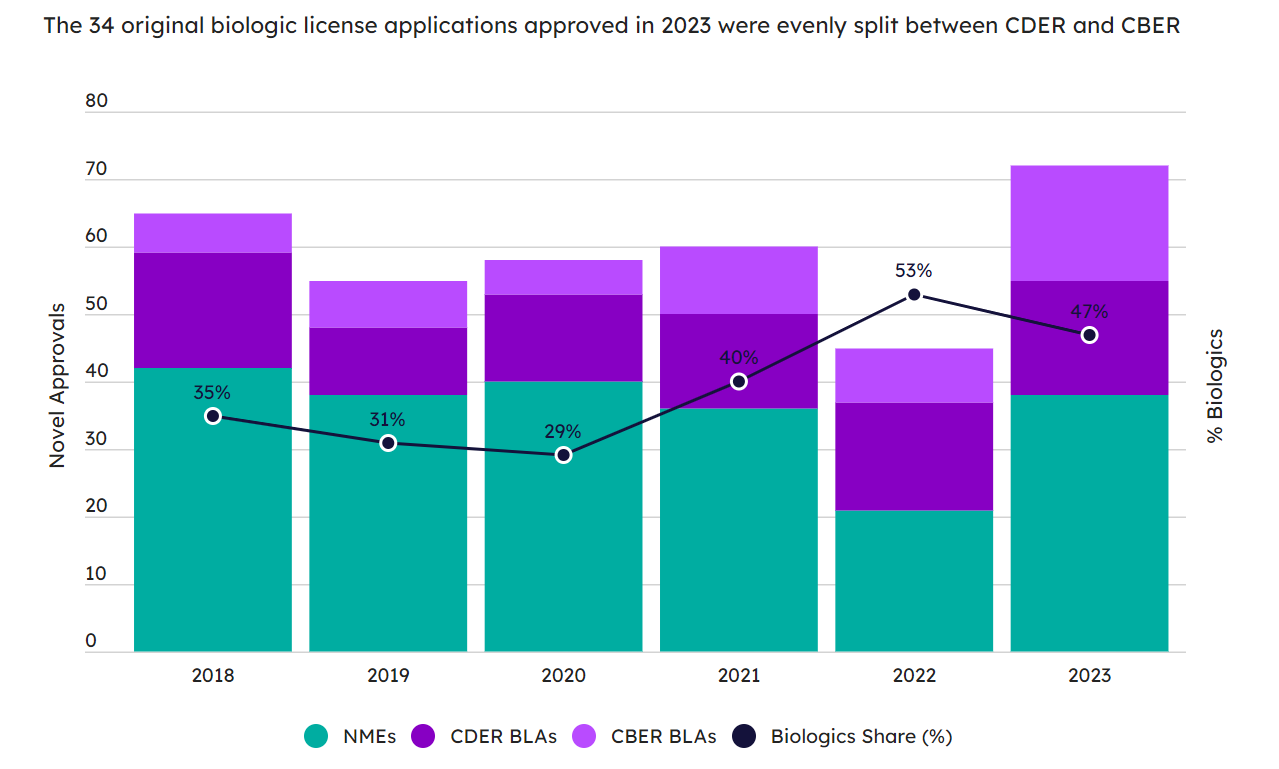
图2. CDER与CBER最近六年批准的NME和生物制剂数量比例走势图。(图片来源:Pink Sheet)
• 突破性疗法认定、优先审评和加速批准对比
历史上,FDA已经对将近500种申请药物授予了突破性疗法认定(BTD,Breakthrough Designation)。在这些获得BTD头衔的申请中,将近60%最后得到了FDA的批准,实现了名利双收;约有25%的BTD仍然在上下求索尚未获批,而28个项目则因临床失败而"身与名俱灭"。图3显示了最近8年CDER的BTD认定以及CBER的BTD/RMAT(再生医学先进疗法认定)认定数量走势。
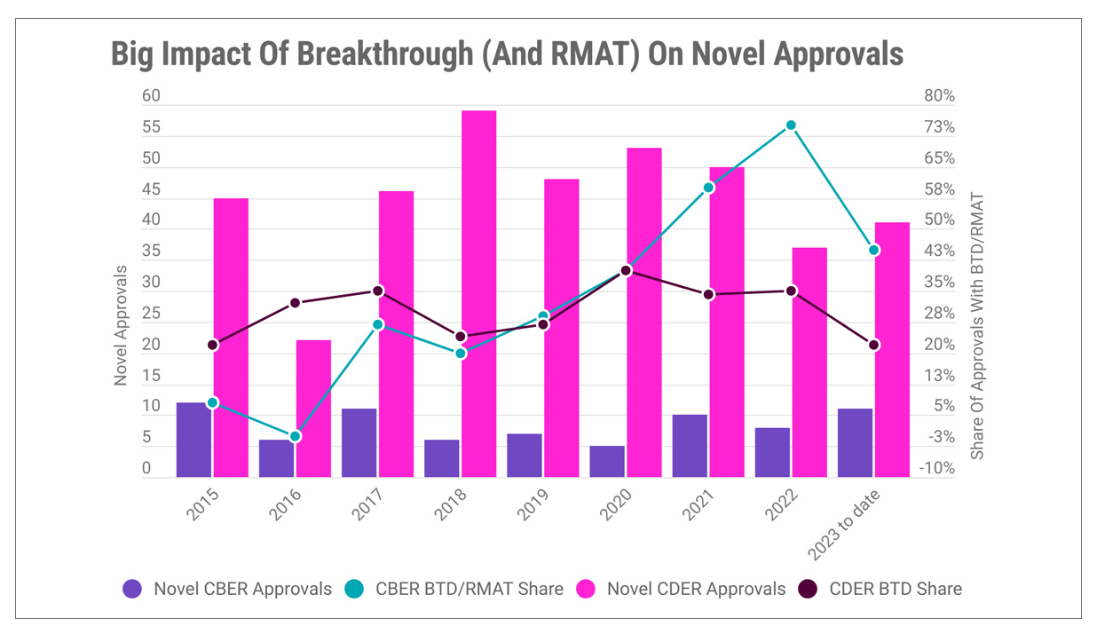
图3. 最近8年CDER/CBER批准数量、CDER突破性疗法认定(CDER BTD)数量以及CBER突破性疗法认定(CBER BTD)和再生医学先进疗法认定(CBER RMAT)数量。(图片来源:Pink Sheet)
从新分子实体和生物制剂的BTD授权差异来看,2023 年批准的 NME 中有 18% 获得了BTD头衔,而新型生物制剂中的比例则高达44%,它们得到了BTD 或 RMAT 的认定。 RMAT 提供与 BTD 类似的益处,包括在开发过程中加强与 FDA 的沟通,但指定门槛相对较低。图4显示了最近8年CDER的BTD认定(包括NME与新生物制剂)与CBER的BTD/RMAT走势。可以看出,从2020年后,CBER的BTD/RMAT比例明显高于CDER。
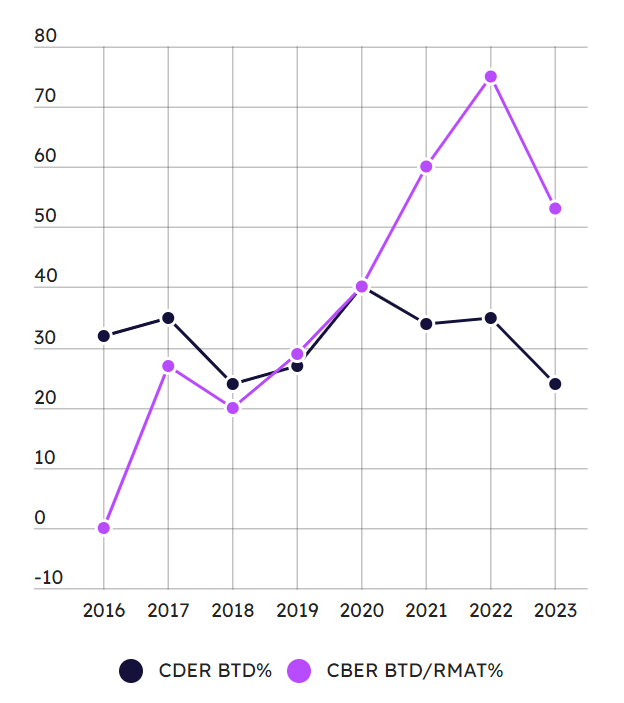
图4. CDER的BTD认定与CBER的BTD/RAMT认定比例最近8年走势图。(图片来源:Pink Sheet)
从模态的角度来看,新生物制剂在优先审评、BTD认定、加速批准和孤儿药认定方面都全面领先新分子实体。
加速批准的政策也明显向生物制剂倾斜。2023年只有 3 个 NME 审批使用了加速审批 (8%),而相比之下,有 8 个生物制剂 (24%) 通过加速批准成功撞线(图5)。
虽然大多数 NME 和生物制品的批准都获得了优先审查,但在34 个 BLA申请中有超过三分之二 (71%)获得了优先审查的头衔(23 种生物制品),而 NME 的这一比例为 55%(21 种药物)(图5)。这个差异说明BLA相对于NDA来说更容易获得优先审查的认定。
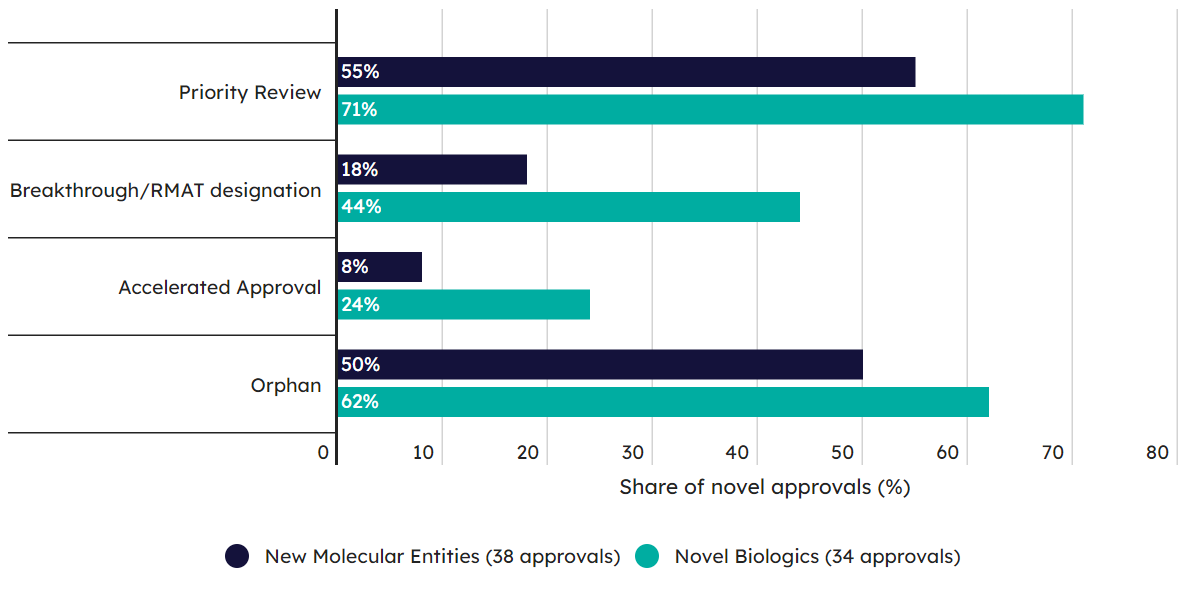
图5. 新分子实体和新生物制剂2023年在优先评审、BTD认定、加速批准和孤儿药认定方面的比例对比图。(图片来源:Pink Sheet)
图6是从CDER与CBER对比的角度,来审视优先审评、BTD认定、加速批准和孤儿药认定方面的差异。从这个角度来看,CBER授予这些头衔时,相对CDER似乎更加宽松一些。
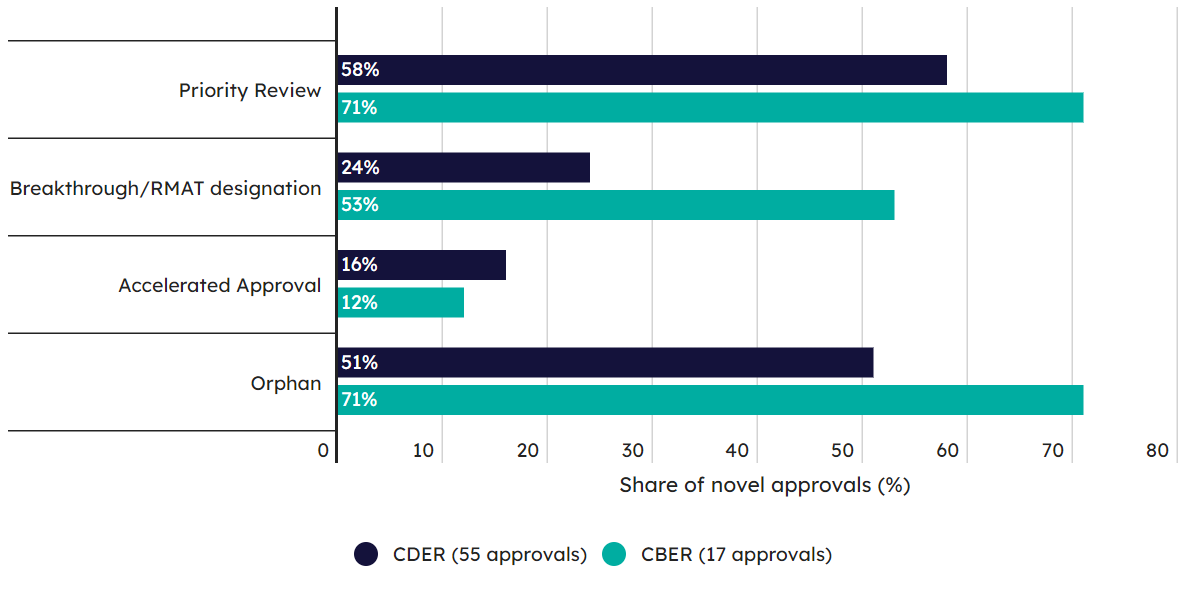
图6. CDER与CBER在优先评审、BTD认定、加速批准和孤儿药认定方面的比例对比图。(图片来源:Pink Sheet)
• NME与新生物制剂的类型细分
2023年的34个BLA批准种,最大的份额来自于单抗药物,其中包括19%的非肿瘤单抗与6%的PD-1/L1抑制剂。排在第二的是疫苗和基因疗法,第三的是双特异性抗体。接下来分别是酶替代疗法、细胞疗法、血浆制品、其它蛋白制剂和肠道菌群制剂(图7)。
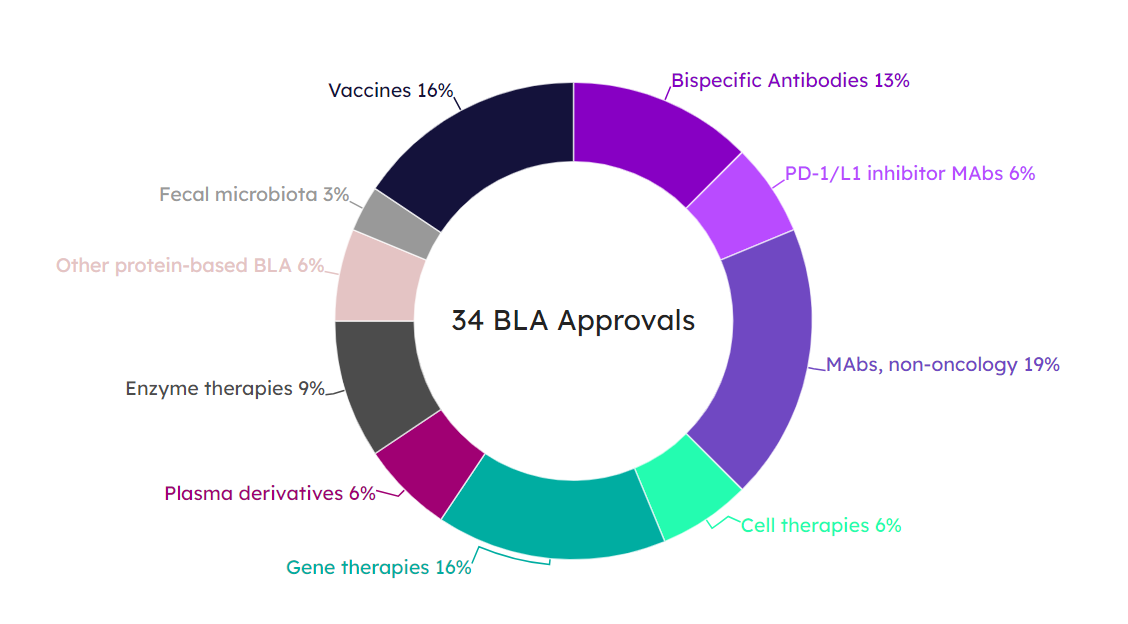
图7. 2023年34款BLA产品类型分布图。(图片来源:Pink Sheet)
38款新分子实体中,最大的来源是激酶抑制剂,其次是抗菌剂、补体抑制剂、类固醇类药物、反义RNA等(图8)。
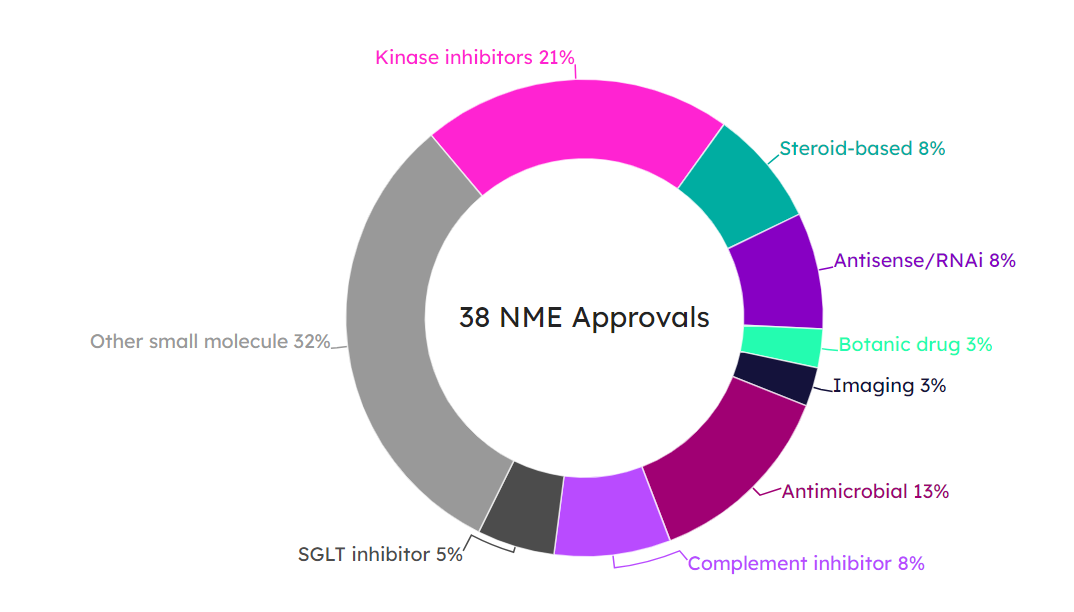
图8. 2023年38款NME产品类型分布图。(图片来源:Pink Sheet)
3. 一将功成万骨枯,获批新药背后的功败垂成
行百里者半九十,除了成功撞线的72款新药之外,2023年还有大量倒在最后一步NDA和BLA申请的候选新药。2023年收到FDA完整回复函(CRL)的申请共计21个。
除了批准函外,FDA 还在 2023 年发布了大量针对新型 NDA 和 BLA 的完整回复函。粉单 FDA 绩效追踪系统的完整回复函图表确定了 2023 年接受 CRL 的 21 种新药。收到CRL并不意味上市希望破灭,礼来溃疡性结肠炎单克隆抗体 Omvoh (mirikizumab-mrkz) 就是这样"从哪里跌倒就从哪里爬起来"的励志代表,它在2023年收到FDA的CRL,重装上阵后重新提交并在2023年10月26日最终获得FDA的批准。
如果将批准和CRL合并在一起统计,那么2023年见证了93次新药(其中Omvoh被统计了2次)的申请,这是一个非常可观的成绩,创下了近6年的新高,其中CRL的次数也是最近6年最多的一回(图9)。这说明了FDA可能秉持了"执两用中"的态度,在审批的宽松性和严格性上做到了"允执厥中"的拿捏。
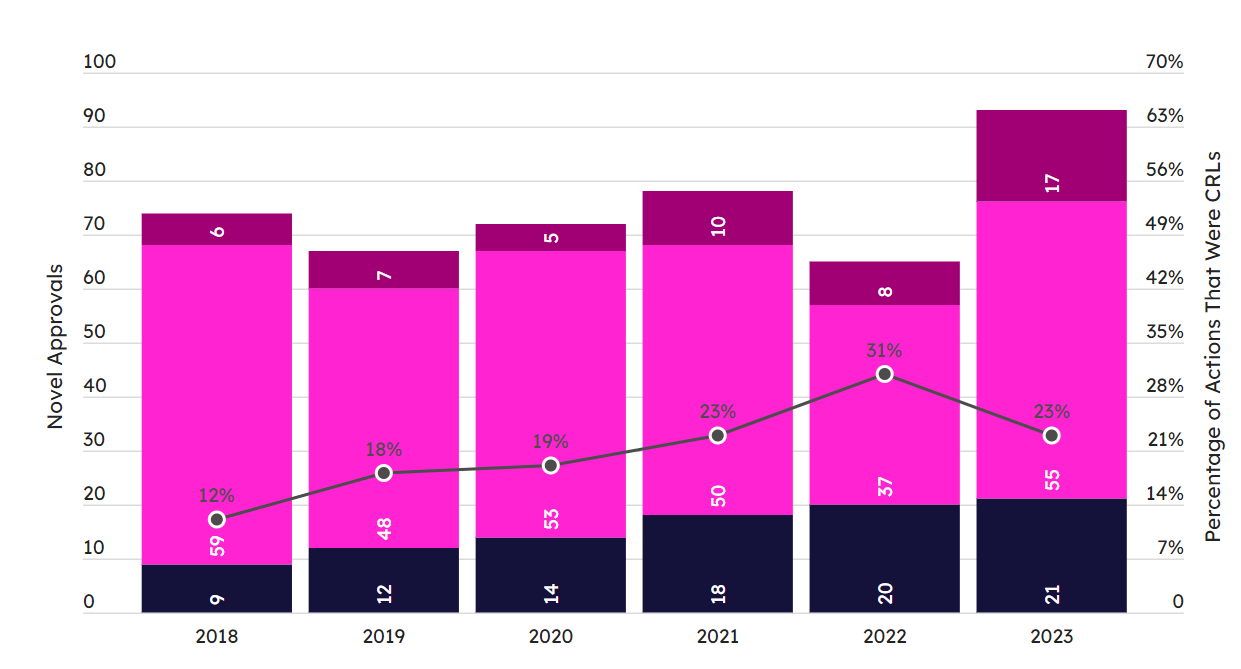
图9. 最近6年FDA批准新药以及签发CRL数量走势图。(图片来源:图片来源:Pink Sheet)
虽然2023 年的21 个 CRL创下了近几年的纪录,但考虑到申请数量的庞大,2023年的申请成功率还是非常可观的。2023年只有23%的新药申请撞到了CRL,而2022年的比例为31%(图9)。从来源看,2023年FDA签发的21封CRL中有20次来自于CDER,只有一封是CBER签发的。这说明了FDA对待先进疗法的宽松性和灵活性。据最新动向显示,FDA很有可能在2024年对Sarepta的杜氏肌营养不良症基因疗法Elevidys放行,将其从之前的加速批准升级到全面批准。值得注意的是,这个可能的决定是建立在Elevidys上市后研究失败的基础之上的,这就更引发了人们对于FDA审批灵活性的争议和讨论。
4. 2024年挑战:如何保持公正性与透明性
FDA的使命是确保公众获得安全、有效和高质量的医疗产品。在这个过程中,药物的批准是一个关键的环节,直接关系到患者的安全和医疗疗效。FDA批准药物的过程面临着一些公正性与透明性的挑战,需要持续的关注和改进。
利益冲突: 在审批过程中,存在一些关于利益冲突的担忧。一方面,制药公司希望推动他们的产品上市以获取利润,另一方面,FDA需要确保这些产品的安全性和疗效。这样的利益冲突可能导致审批过程中的公正性问题被放大。
审批速度和质量的平衡: FDA在确保审批速度的同时,也要保证审批质量。然而,由于一些药物的急需性,有时可能会出现加速审批的情况,可能导致对一些潜在的安全风险未能进行充分评估。
评审过程的透明性: FDA在对药物进行审评时,公开审评过程中的文件和数据,使公众能够查看审评的细节。这包括对临床试验数据、药物效果和安全性的评估,以及专家委员会的建议。当FDA作出决策时,透明性要求其及时公布决策结果,并提供详细的解释,包括对药物安全性、有效性以及批准或拒绝的理由。
Aduhelm(Aducanumab)就是FDA在批准药物过程中引发巨大争议的缩影。阿尔茨海默病药物aducanumab 的临床试验结果曾经存在争议。一些研究表明,Aducanumab 可能对阿尔茨海默病患者的认知功能产生积极影响,而其他研究则未能证实这一效果。这种不一致性引发了对试验设计和数据分析的质疑。由于Aducanumab 的治疗效果仍然存在一定的不确定性,一些专家和研究人员对其实际疗效提出了质疑,包括是否真正能够减缓阿尔茨海默病的发展。尽管存在争议,并且FDA的专家咨询委员会给出了压倒性的否决投票,FDA 仍然于2021年6月批准了 Aducanumab,使其成为第一个获批的阿尔茨海默病生物制品。这一决定立即引发了轩然大波,三名专家委员会成员最终因这一决定而辞职,很多专家和科学家质疑这个决定的科学依据,并认为其批准过程缺乏透明度。就连美国国会对FDA的这一决定进行了批评,称FDA在批准Aduhelm 时未能遵循自己的指导和做法,审批程序"充斥着违规行为"。Aducanumab 的定价也成为争议的焦点。其高昂的价格引发了社会对药品定价和可及性的广泛担忧,特别是考虑到其疗效和争议性。
2024年对于FDA的一个巨大挑战来自于他们对Sarepta的杜氏肌营养不良症(DMD)基因疗法Elevidys的决定。这款历史上第一个DMD基因疗法在去年6月顶着巨大的争议获得了CBER的加速批准。在随后的上市后研究中没有能够达到主要终点,只是在几个关键的次要临床终点上实现了显著性改善。尽管如此,Sarepta仍然提交了补充BLA申请,要求FDA对Elevidys进行全面批准,并将标签适用年龄从当前的四至五岁拓展到全部年龄范围。这个烫手的山芋,在巨大的未满足现状、患者群体呼吁、专家的质疑和民众的关注面前,令FDA感觉到芒刺在背般的不适。在做决定的过程中,稍有不慎就可能陷入"不审势即宽严皆误"的境地。
从目前的情况来看, FDA基因疗法最高监管者Peter Marks 倾向于将Elevidys的加速批准升级到全面批准,这个结果必然将引发强烈争议。Peter Marks在当初加速批准Elevidys的决定中就发挥了一言九鼎的作用,尽管当时CBER内部甚至有拒绝审查Elevidys的呼声,但最终的加速批准还是令很多人感到惊讶。Marks曾经暗示,只要数据足够好,基因疗法开发商就不必再担心临床试验是否真正成功。这种开着左转灯右转的行为令很多人感到不适。
Marks一直对优待基因疗法,以高度灵活性加速批准基因疗法倾向丝毫不遮掩。他认为,对于出生时患有严重和致命罕见疾病的人来说,即使关于益处的问题尚未得到解答,加速潜在有益的疗法上市也是值得冒的风险。"我不会因此而失眠",Marks在接受STAT采访时如是说。
从目前态势来看,CEBER将几乎肯定全面批准Elevidys对于4-5岁DMD患儿,而且很有可能将标签扩大到6-7岁的患者。不管怎样,Elevidys的监管审查,将是FDA 2024年面对的一件大事,对于FDA的科学性、严谨性、灵活性和透明度,都将是一场大考。
参考资料:
Petersen, D. Top Seven Pink Sheet Infographics Of 2023. Pink Sheet. 04. 01. 2024.
Silverman, B. Big Totals And Big Margins: US FDA Approved 72 Novel Agents In 2023 - And Acted On 90+. Pink Sheet. 01. 01. 2024.
Silveman, B. Biologics Overshadow Small Molecules In US FDA's 2023 Novel Approvals. Pink Sheet. 05. 01. 2024.
Feuerstein, A. FDA's Peter Marks seems inclined to grant full approval to Sarepta's Duchenne gene therapy. STAT. 09. 01. 2024.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57