2025年预计有多款里程碑式的疗法将获得FDA的批准,并有可能获得良好的商业回报。例如Vertex的囊性纤维化药物Alyftrek,已于去年年底获得批准,预计将在2030年实现80亿美元以上的年销售额。阿斯利康和第一三共的乳腺癌ADC药物Datroway于今年1月获得FDA批准,有望在2030年达到50亿美元的年销售额高度。
一、Alyftrek (vanzacaftor/tezacaftor/deutivacaftor)
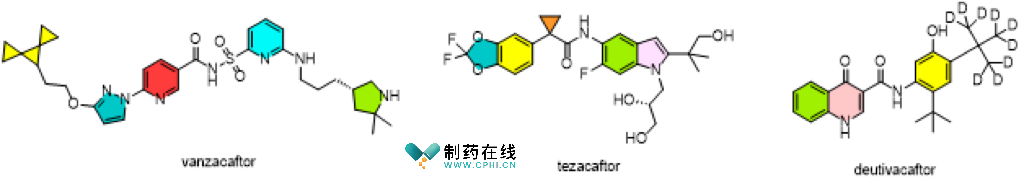
●开发商:Vertex
●模态:小分子
●适应症:囊性纤维化
●监管状态:已批准(2024年12月20日)
●预测2030年销售额:83.4亿美元
●背景与意义:Alyftrek代表着一种崭新的三重组合 CFTR 调节剂疗法:vanzacaftor、tezacaftor 和 deutivacaftor,适用于6岁及以上携带至少一个对该疗法有反应突变的囊性纤维化(CF)患者。囊性纤维化是由CFTR基因突变引起的,这个基因负责CFTR蛋白质的生成,基因突变导致这种蛋白质功能障碍或缺失,从而导致体内产生异常粘稠的粘液,积聚在器官中,引发大多数CF症状。CFTR调节剂可以改善那些由CFTR基因中特定突变引起的囊性纤维化患者的CFTR蛋白功能。Alyftrek为CF患者提供了崭新的选择,特别是对于无法耐受Trikafta(同样为Vertex产品)的患者。除此之外,Alyftrek只需每日服用一次,相较于其他调节剂每日两次的服用方案,可能使患者的用药更加便利。
二、Datroway (datopotamab deruxtecan)
●开发商:阿斯利康/第一三共
●模态:ADC
●适应症:既往接受过治疗的转移性 HR 阳性、HER2 阴性乳腺癌
●监管状态:已批准(2025年1月17日)
●预测2030年销售额:49.8亿美元
●背景与意义: 美国每年新检测出的乳腺癌患者超过30万人。虽然早期乳腺癌的生存率较高,但转移性患者存活时间超过5年的比例只有30%。大约70%的乳腺癌确诊病例属于HR阳性、HER2阴性乳腺癌。HR阳性转移性乳腺癌的早期治疗中,内分泌疗法被广泛使用。然而,初步治疗后,内分泌治疗的疗效通常有限。目前在内分泌治疗后的标准治疗是化疗,但化疗的反应率和治疗效果较差。在这样的情况下,Datroway的获批显得意义非常重大。Datroway用于治疗无法手术切除或转移性HR阳性、HER2阴性乳腺癌的成人患者,这些患者已接受过内分泌疗法和化疗的治疗。这种新型的TROP2靶向ADC药物的批准标志着一个重要的治疗里程碑,为转移性乳腺癌患者提供了常规化疗之外的新选择。
三、Nivolumab Enhanze
●开发商:百时美施贵宝
●模态:单抗
●适应症:多发性硬化症
●监管状态:已递交申请(PDUFA日期2025年2月28日)
●预测2030年销售额:39.1亿美元
●背景与意义:Halozyme与 Bristol Myers Squibb 合作,已提交 Opdivo® (nivolumab) 与 Enhanze® 联合制剂的BLA申请,用于治疗多发性硬化症 (MS)。Opdivo 是BMS的王牌PD-1 免疫检查点抑制剂。该药物利用 Halozyme 的 Enhanze® 技术来改善药物输送。Enhanze®通过提高药物的皮下给药效率,改善患者的治疗体验。该技术的核心是利用重组人透明质酸酶PH20(rHuPH20)来分解皮下组织中的透明质酸,透明质酸是皮肤和结缔组织中的一种天然屏障物质。通过暂时降低透明质酸的粘性,Enhanze® 技术能够加速皮下药物的吸收,使大分子药物更快、更高效地进入血液循环。这种方式不仅可以减少药物给药时间,改善患者的舒适度,还能在某些情况下减少静脉注射的需求,使得许多原本需要通过静脉注射的药物可以通过皮下注射给药。
四、Journavx (suzetrigine)
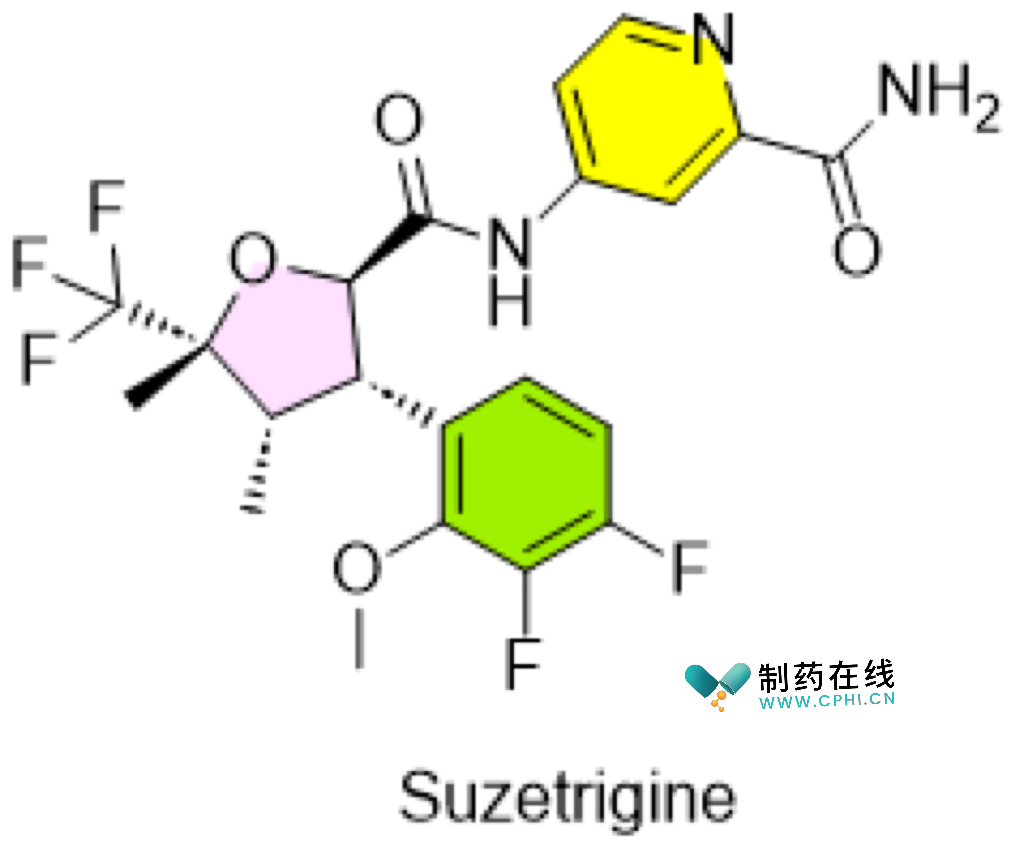
●开发商:Vertex
●模态:小分子
●适应症: 中度至重度急性疼痛
●监管状态:已批准(2025年1月30日)
●预测2030年销售额: 29亿美元
●背景与意义:Vertex的Journavx(suzetrigine)获得FDA批准,用于治疗成人中度至重度急性疼痛,成为近20年来首个非阿 片类镇痛药。Journavx通过阻断NaV1.8钠离子通道发挥作用,这一新机制标志着疼痛治疗领域的重要突破。与传统阿片类药物不同,它不具有成瘾性,并且在临床试验中显示出与阿片类药物相当的止痛效果,但副作用较少。
Journavx的成功推动了NaV1.8抑制剂的进一步开发,目前有多个候选药物正在进行临床试验。尽管NaV1.7和NaV1.8钠通道一直被认为是疼痛治疗的潜在靶点,但开发具有高度选择性的药物一直面临挑战,特别是由于这些通道在其他组织中具有高度同源性。Journavx的选择性优势使其在不影响其他身体功能的前提下有效缓解疼痛。
未来,Journavx及其同类药物有望取代阿片类药物,解决长期困扰的成瘾性问题,同时在急性和慢性疼痛治疗领域发挥更大作用。
五、Brensocatib
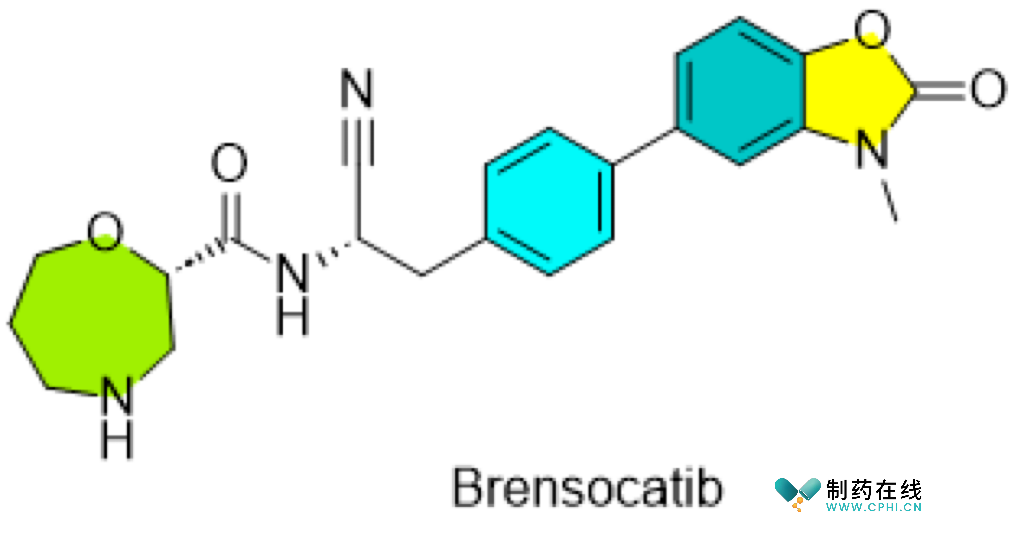
●开发商:Insmed
●模态:小分子
●适应症: 非囊性纤维化支气管扩张
●监管状态:已递交NDA申请(PDUFA日期2025年8月12日)
●预测2030年销售额: 28.4亿美元
●背景与意义:尽管非囊性纤维化支气管扩张(支气管扩张症)的患病率近年来有所增加,但它仍被广泛忽视。患者常表现出慢性咳嗽、痰液产生以及反复的呼吸道感染和加重发作,这些症状严重影响患者的生活质量并增加住院风险。支气管扩张症的病因复杂,病情表现和严重程度因人而异,这种异质性给临床管理带来了巨大挑战。尽管目前患者可以使用一些现有的治疗方法,但FDA和EMA尚未批准任何针对支气管扩张症的专门药物。当前的管理措施主要集中在清理气道、使用黏液活性剂和抗生素治疗急性发作,而长期使用抗生素则面临耐药性问题。目前正在进行的 3 期 ASPEN 试验是支气管扩张症领域规模最大的全球研究,旨在评估 Brensocatib 对支气管扩张症加重发作率的影响。
Brensocatib 是一种口服的选择性 DPP-1 (二肽基肽酶1)抑制剂,可作为中性粒细胞介导疾病(包括支气管扩张和无鼻息肉的慢性鼻窦炎)的潜在治疗方法。如果获得FDA批准,将成为首 款支气管扩张症专用药物。
六、Aficamten
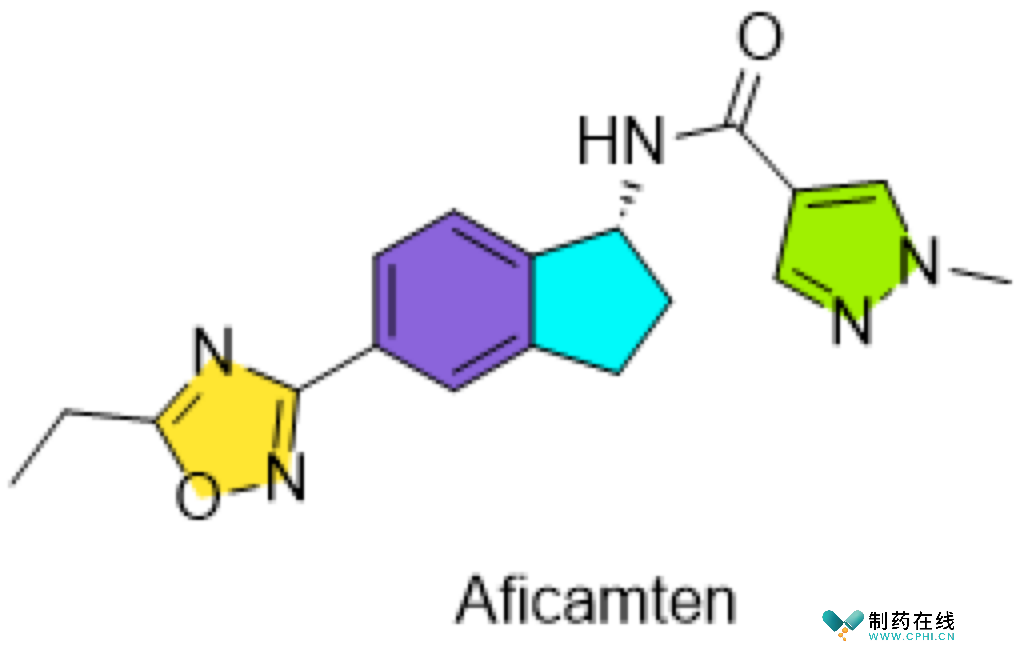
●开发商:Cytokinetics
●模态:小分子
●适应症:阻塞性肥厚型心肌病
●监管状态:已递交NDA申请(PDUFA日期9月26日)
●预测2030年销售额:26亿美元
●背景与意义:肥厚型心肌病(HCM)是最常见的单基因心脏疾病,估计大约影响1/500的人口。其主要由肌节的染色体显性突变引起,其中β-心脏肌球蛋白(MYH7)和心脏肌球蛋白结合蛋白C(cMYBP-C, MYBPC3)的突变占据了约50%的家族性HCM病例。Ficamten是一种选择性的小分子心脏肌球蛋白抑制剂,通过显著减缓磷酸盐释放,降低ATP酶活性,稳定肌球蛋白与肌动蛋白的弱结合状态。Aficamten具备成为治疗肥厚型心肌病有效药物的潜力。
七、Tolebrutinib
●开发商:赛诺菲
●模态:小分子
●适应症:非复发性继发进展型多发性硬化症
●监管状态:III期试验HERCULES于2024年9月实现主要终点
●预测2030年销售额:13.7亿美元
●背景与意义:FDA已于2024年12月13日授予tolebrutinib突破性疗法认定,用于治疗非复发性继发进展型多发性硬化症(nrSPMS)成人患者。与安慰剂相比,Tolebrutinib能将6个月确认的残疾进展(CDP)的发生时间延缓31%(HR 0.69;95% CI 0.55-0.88;p=0.0026)。Tolebrutinib是首个能够穿透大脑的BTK抑制剂,在多发性硬化症领域获得了突破性疗法认定。目前对于非复发性继发进展型多发性硬化症(nrSPMS)尚无获批药物。
八、Remibrutinib
●开发商:诺华
●模态:小分子
●适应症:慢性自发性荨麻疹(CSU)
●监管状态:预计2025年初递交NDA申请
●预测2030年销售额:13亿美元
●背景与意义:CSU指持续 6 周或更长时间的慢性荨麻疹,影响全球约 4000 万人。其特征是突然出现瘙痒的荨麻疹或深层组织肿胀(血管性水肿,可发生在面部、喉咙、手和脚上)。CSU 会引起严重的情绪困扰,大多数患者睡眠不足,焦虑或抑郁等精神障碍发生率很高,并且会影响他们的工作效率。抗组胺药通常用于治疗 CSU,因为它们可以阻断组胺受体并阻止组胺的促炎作用,从而导致瘙痒和肿胀。然而,超过 50% 的 CSU 患者无法单靠 H1 抗组胺药来控制。
诺华的BTK抑制剂remibrutinib在关键的 III 期研究 REMIX-1 和 REMIX-2 中显示出显著的症状改善能力。Remibrutinib是一款高选择性共价口服 BTK 抑制剂,可阻断 BTK 级联并防止引起瘙痒性荨麻疹和肿胀的组胺释放。除了 CSU,remibrutinib还在其他几种免疫介导疾病中进行研究,例如化脓性汗腺炎,它在 II 期研究中达到了主要终点。
九、Depemokimab
●开发商:GSK
●模态:单抗
●适应症:伴有 2 型炎症的哮喘以及慢性鼻窦炎伴鼻息肉 (CRSwNP)
●监管状态:临床III期,向EMA递交申请
●预计2030年销售额:11.3亿美元
●背景与意义:在欧洲估计有超过 4200 万人患有哮喘,给患者的生活和医疗资源带来了沉重的负担,估计每年的社会成本为 460 亿欧元。CRSwNP(慢性鼻窦炎伴鼻息肉)是一种慢性疾病,影响多达 4% 的普通人群。
Depemokimab 是一种针对白细胞介素 5 (IL-5) 的单抗,是首个针对2型炎症哮喘和CRSwNP进入III 期试验的超长效生物制剂。Depemokimab 作为 2 型炎症哮喘患者的附加疗法,降低了病情恶化和住院率;与安慰剂相比,depemokimab 可减小鼻息肉大小和减少鼻塞。研究结果支持六个月 (26 周) 的给药方案。在哮喘患者和 CRSwNP 患者中,临床试验表明 depemokimab 可以持续抑制疾病的关键驱动因素,每年仅注射两次。
十、Penmenvy (MenABCWY)
●开发商:GSK
●模态:疫苗
●适应症:五合一脑膜炎疫苗
●监管状态:已获批(2025年2月14日)
●预计2030年销售额:12.4亿美元
●背景与意义:2025年2月18日, FDA批准了新的5合1疫苗Penmenvy,用于预防10至25岁人群中的脑膜炎球菌感染或侵袭性脑膜炎球菌病(IMD)。Penmenvy将两种已获批准的疫苗的活性成分结合在一起,提供更好的保护,同时减少接种次数,简化了接种流程。
IMD是一种罕见但致命的感染,由脑膜炎奈瑟菌引起,可能导致脑膜炎(脑部肿胀)、败血症(血液感染),甚至在数小时内死亡。幸存者可能面临脑损伤、截肢、听力丧失和神经问题。16至23岁的青少年和年轻成年人风险更高。然而,只有不到13%的人完成了两剂疫苗接种,只有32%的人至少接种了一剂。
Penmenvy结合了Bexsero和Menveo疫苗的部分成分,通过一次注射保护免受五种最常见的脑膜炎奈瑟菌(A、B、C、W和Y)菌株的感染。此疫苗的简化接种方式可能会鼓励更多人进行免疫接种。
参考文献:
1.Wexler, M. FDA approves Alyftrek, once-daily triple-combination therapy for CF. Cystic Fibrosis. 02. 01. 2025.
2.Datroway (datopotamab deruxtecan) approved in the US for patients with previously treated metastatic HR-positive, HER2-negative breast cancer. AZ Press Release. 17. 01. 2025.
3.Harrison, C. Vertex’s opioid-free drug for acute pain wins FDA approval. Nature Biotechnology. 2025. https://doi.org/10.1038/s41587-025-02590-3
4.Hartman, J. J., et al. Aficamten is a small-molecule cardiac myosin inhibitor designed to treat hypertrophic cardiomyopathy. Nat Cardiovasc Res 3, 1003–1016 (2024). https://doi.org/10.1038/s44161-024-00505-0
5.Press Release: Tolebrutinib designated Breakthrough Therapy by the FDA for non-relapsing secondary progressive multiple sclerosis. Sanofi Press Release. 13. 12. 2024.
6.Novartis Phase III data confirm sustained efficacy and long-term safety of oral remibrutinib in chronic spontaneous urticaria. Novartis Press Release. 31. 05. 2024.
7.Depemokimab accepted for review by the European Medicines Agency for use in asthma with type 2 inflammation and CRSwNP. GSK Press Release. 28. 01. 2025.
8.Das, J. FDA Approves 5-in-1 Vaccine Against Meningococcal Disease. WebMD.
9.McConaghie, A. et al. 2025’s Biggest New Launches. Scrip. 19. 02. 2025.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57