2024年01月08日,全国团体信息平台发布了由上海市医药质量协会、上海药品审评核查中心等共同起草的《细胞治疗产品生产用空间密闭系统应用指南》(T/SHQAP 003—2023)团体标准,2024年02月07日起实施。本文件提供细胞治疗产品生产用空间密闭系统(细胞制备隔离器和配套的培养系统)的术语和定义,并在设备的配置、设备的确认、无菌工艺模拟、生产工艺验证考虑、系统风险控制、生物安全控制等方面提供建议,以降低细胞治疗产品生产中可能产生的外源污染风险、交叉污染风险、混淆差错风险、生物安全风险,提升生产工艺的无菌保障水平,提升用药安全,弥补了国内细胞治疗产品生产用空间密闭系统应用领域的空白。
一、细胞治疗产品生产设施与设备有哪些特殊考虑?
细胞治疗产品的生产设施与设备需要考虑多个方面的特殊要求,以确保产品的质量和安全性。这些要求包括但不限于设备的隔离和独立性、操作环境的洁净度级别选择以及密闭系统的使用等。遵循这些特殊考虑因素有助于确保细胞治疗产品的可靠性和有效性。细胞治疗产品生产用空间密闭系统一般由细胞制备隔离器、培养系统等一个或多个密闭设备组成,其目的是为满足细胞治疗产品生产过程工艺复杂、单批次规模小、个性化水平高等特点,而提供的一种定制化密闭系统,可为细胞治疗产品的生产过程的敞口操作和培养过程提供无菌密闭环境,避免在生产过程中受到外源污染或批间交叉污染,并降低混淆和差错的风险。细胞制备隔离器与培养系统配合使用时,隔离器与培养系统上配置的培养箱之间,笔者梳理了相关指南对细胞治疗产品生产设施与设备的特殊考虑,如下表:

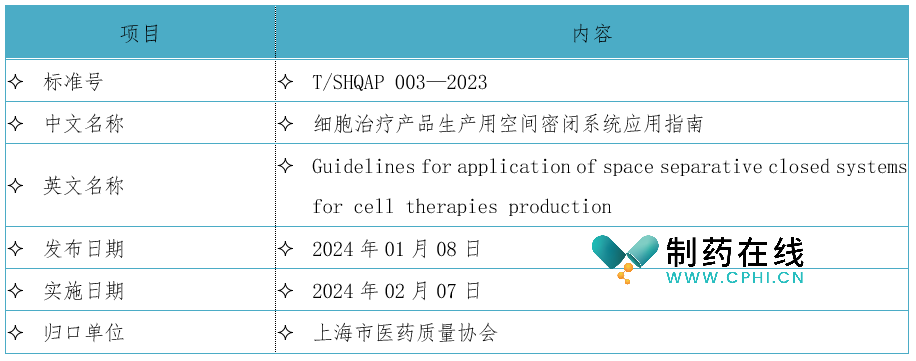
二、《细胞治疗产品生产用空间密闭系统应用指南》标准信息
三、《细胞治疗产品生产用空间密闭系统应用指南》起草单位和起草人

参考文献
[1] www.ttbz.org.cn和上海市医药质量协会官网



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57