2023年,国内1类化药首次IND注册申报,共计311个品种,年增长37%,创下历史新高,交出满意年度答卷。
与此同时,进口1类化药IND情况如何?与中国制药巨头同台竞技的跨国药企们,又是哪些?
为此,笔者特别盘点了进口1类化药IND「年终总结」,以飨读者。
注:文末附2023年首次受理的1类化药进口IND品种表。
01
近3年我国1类化药进口IND品种注册受理趋势
通过查询药智数据,承办时间分别选择2021、2022、2023全年,药品类型选择“化药”,注册分类选择“1类”,任务类型选择“IND”,申请类型选择“进口”,按品种统计结果显示:
1)2021年的申报量为118个、已批准品种112个、申报企业共72家;
2)2022年的申报量为106个、已批准品种102个、申报企业共58家;
3)2023年的申报量为90个、已批准品种77个、申报企业共46家。
具体如下图所示。
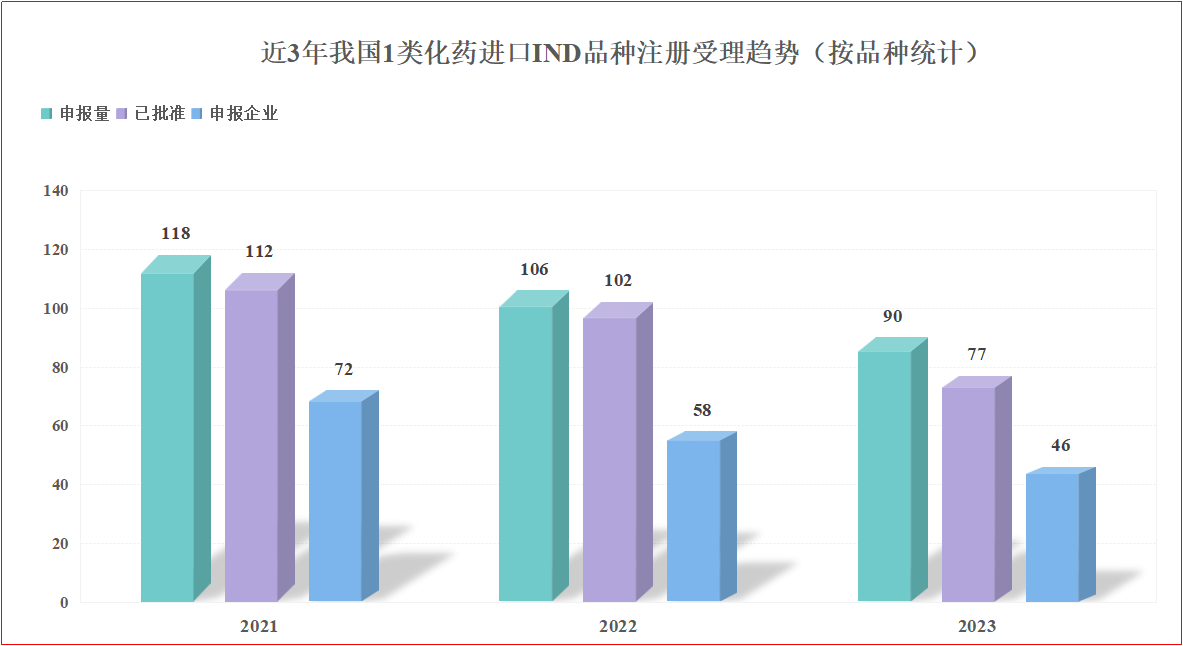
图1 2021年-2023年,我国1类化药进口IND品种注册受理趋势(按品种统计)
数据来源:药智数据
02
2023年1类化药进口申办方及IND品种特点
按品种统计,2023年申报企业排名靠前的有阿斯利康、勃林格殷格翰制药、礼来制药、辉瑞制药、百时美施贵宝、罗氏制药、诺华制药、拜耳制药、默沙东、Incyte Corp等,大都为全球大型制药公司。
另,如上所述2023年的品种数量为90个,其中已有4个品种纳入突破性治疗,分别为VSA001注射液(在低脂饮食和其他降脂疗法的基础上,可以降低家族性乳糜微粒血症综合征成人患者的甘油三酯水平)、VSA003注射液(用于在饮食疗法和其他降脂治疗基础上且需要进一步降低LDL-C的HoFH患者,或其他降脂治疗无效、或不耐受其他降脂治疗的HoFH患者)、Lanifibranor片(拟用于治疗伴有肝纤维化的非肝硬化非酒精性脂肪性肝炎的成人患者)、Vamorolone口服混悬液(用于治疗2岁及以上患者的杜氏肌营养不良)。
再,2个品种为放 射性药物,分别为ITM Solucin GmbH&Grand Pharmaceutical(China)开发的镥[177Lu]依多曲肽注射液和Telix International Pty Ltd&Grand Pharmaceutical开发的碘[131I]-IPA注射液。
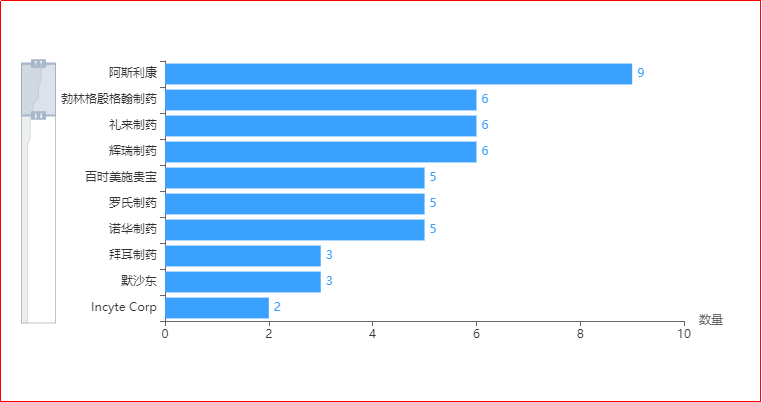
图2 2023年国内进口1类IND受理品种企业排布(按品种统计)
图片来源:药智数据
03
2023年首次受理的1类化药进口IND品种介绍
首次受理品种,相对来说更具创新代表性。为了更全面详细的介绍2023年首次受理的1类化药进口IND品种,首先将上述品种进行数据库查重,确认为2023年首次国内申请,后进行全网搜索公开信息,细化品种信息,由此更能表现进口化药IND品种的类别、方向和差异化特点。
NO1~BRM421滴眼液
GPN00136(BRM421),为全球创新的小分子多肽滴眼液产品,通过加速角膜缘干细胞的分裂增殖,促进眼表修复以治疗干眼症。远大医药曾发布公告,集团用于治疗干眼症的小分子多肽药物GPN00136(BRM421)的II期临床试验申请,是一项单臂、开放标签的II期临床研究,拟入组不超过40例的中重度干眼症患者,旨在评估BRM421治疗中重度干眼症患者的有效性和安全性。
NO2~VSA001
VSA001,是一款治疗脂质代谢紊乱的肝脏靶向siRNA药物,可通过有效且持久地沉默载脂蛋白C3的信使RNA(APOC3 mRNA)来降低APOC3蛋白水平表达。2023年5月,维亚臻宣布VSA001注射液在北京大学第三医院顺利完成首例受试者给药,这是一项随机、双盲、安慰剂对照的1期临床试验,旨在评估VSA001在中国成年健康志愿者中的安全性、耐受性以及药代动力学和药效动力学特征。2023年7月,维亚臻又宣布VSA001注射液在中南大学湘雅二医院顺利完成3期临床试验首例患者给药。
NO3~Milvexian片
Milvexian,为新一代口服凝血因子XIa抑制剂。Fierce Biotech曾指出,这款疗法有望成为重磅抗凝血疗法。2023年5月,强生和百时美施贵宝公司宣布Milvexian获得美国FDA快速通道资格,用于3期研究项目评估的所有三种适应症:缺血性卒中、急性冠状动脉综合征和心房颤动。据强生新闻稿,项目旨在研究Milvexian是否可以通过减少血栓形成事件而不增加出血风险来提高治疗这三种疾病患者的获益-风险概况。
NO4~VSA003
VSA003,是一款靶向血管生成素样蛋白3(ANGPTL3)的小干扰核酸(siRNA)药物,通过LDLR非依赖性及依赖性的双重降脂机制,降脂效果不受LDLR功能影响,可有效降低HoFH患者LDL-C水平。2024年1月29日,维亚臻生物技术(上海)有限公司宣布,其在研小核酸类创新药VSA003注射液已被国家药品监督管理局药品审评中心纳入突破性治疗药物品种名单,该药物拟用于治疗纯合子型家族性高胆固醇血症(HoFH)。
NO5~碘[131I]-IPA注射液
碘[131I]-IPA注射液,是远大医药的一种基于放 射性核素-小分子偶联技术用于治疗多形性胶质母细胞瘤的治疗性放 射性药物,可自由通过血脑屏障进入大脑,并靶向胶质母细胞瘤过度表达的L型氨基酸转运蛋白1(LAT-1)精准辐射癌细胞,促使其凋亡以达到治疗效果,有望成为胶质母细胞瘤治疗领域中的一种开拓性的治疗手段。目前,该品种已获美国FDA孤儿药认定,在欧洲和澳洲开展的I/II期临床试验也在顺利进行中。
NO6~PF-07248144片
PF-07248144,是辉瑞在研的一款选择性KAT6抑制剂,目前正在全球开展1期临床试验,于我国已获得临床试验默示许可,拟定适应症为:与PF-07220060(一款CDK4抑制剂,此前已多次在中国获批临床)和内分泌治疗联合,用于晚期或转移性实体瘤的治疗。
NO7~镥[177Lu]依多曲肽注射液
镥[177Lu]依多曲肽注射液(ITM-11),是ITM Solucin GmbH&远大医药(中国)有限公司研发的1类新药放 射性治疗药物,是一款基于放 射性核素偶联技术靶向治疗GEP-NETs的RDC药物。ITM-11将无载体177Lu与生长抑素类似物偶联,通过与GEP-NETs表面高水平表达的生长抑素受体(SSTR)结合靶向杀伤肿瘤细胞,为肽受体放 射性核素疗法(Peptide Receptor Radionuclide Therapy,PRRT),是RDC药物治疗方式之一。当前已获国内CDE临床试验默示许可,同意开展“适用于不可手术、进展性、生长抑素受体阳性的胃肠道或胰腺来源高分化神经内分泌肿瘤”的临床研究。
NO8~KM-001
KM-001,是Kamari Pharma在研的一种治疗瘙痒的新型药物,其作用机理是通过抑制TRPV3的活性来调节其参与的生理过程和疾病发展。国内,KM-001已有两项1期临床试验,旨在评估其治疗慢性单纯性地衣和点状掌跖角化病/先天性厚甲症患者中的安全性和疗效。试验将通过测量疾病严重程度、皮肤病变面积等指标来评估药物的疗效,并记录药物的不良事件和安全性。这些临床试验结果将有助于评估KM-001乳膏在治疗这些皮肤疾病中的潜在价值,并为KM-001乳膏的临床开发提供更多的科学数据支持。
NO9~Lanifibranor片
Lanifibranor片,是一种口服过氧化物酶体增殖物激活受体(PPAR)激动剂,可同时激活PPARα、PPARδ和PPARγ,这些受体在调控脂质代谢、炎症反应和纤维化过程中发挥重要作用。该药物通过作用于这三种PPAR亚型来调节脂肪代谢,减轻肝脏炎症和纤维化。此前,美国FDA已授予Lanifibranor用于治疗NASH的突破性疗法认定和快速通道资格。2022年9月,正大天晴与Inventiva公司签订许可协议,获得了Lanifibranor在大中华区的独家许可。2023年7月24日CDE官网公示,正大天晴药业集团股份有限公司的1类新药Lanifibranor片拟纳入突破性治疗品种,拟用于治疗伴有肝纤维化的非肝硬化非酒精性脂肪性肝炎的成人患者。
NO10~Zavegepant
Zavegepant,是第三代高亲和力、高选择性的小分子CGRP受体拮抗剂,通过可逆性地阻断CGRP受体,从而抑制CGRP神经肽的生物活性,可以实现缓解与预防偏头痛发作。2023年3月美国FDA已批准Zavegepant用于成人有或无先兆偏头痛的急性治疗,这是第一个也是唯一一个CGRP受体拮抗剂鼻腔喷雾剂。
NO11~LY3502970胶囊
LY3502970胶囊,是礼来开发的一款新型、高效、口服的非肽类GLP-1R激动剂,最初由Chugai开发。2022年10月,礼来公布了I期临床研究的积极结果,每日一次LY3502970治疗组显示出与GLP-1R激动剂注射制剂相当的安全性、强效的降糖疗效以及显著的减重效果。
NO12~Zibotentan胶囊
Zibotentan胶囊,是阿斯利康申报的1类新药,拟和达格列净片联合治疗肝硬化伴门静脉高压症患者。据阿斯利康公开资料,Zibotentan是一款小分子内皮素受体选择性拮抗剂,拟与达格列净组成联合疗法,用于治疗慢性肾脏病和肝硬化。
NO13~Iberdomide胶囊
Iberdomide,是一款靶向Ikaros/Aiolos(IKZF1/3)的蛋白降解疗法,也是一款基于度胺类分子进一步优化产生的分子胶类化合物。根据百时美施贵宝官网,Iberdomide目前有两项适应症已经进入3期临床试验阶段,在治疗接受过多种前期治疗的多发性骨髓瘤患者的临床试验中,Iberdomide与其它多发性骨髓瘤标准治疗药物联用,已经表现出良好的抗癌活性。
NO14~ASP1570片
ASP1570,是安斯泰来开发的一种新型DGKζ抑制剂,具有增强DAG下游信号通路的潜力,可以激活T细胞,而不受PD-1信号通路的影响,从而增强肿瘤杀伤作用。临床前研究表明,ASP1570可恢复被多种免疫抑制信号(PD-1,转化生长因子β,前列腺素E2和腺苷)抑制的T细胞功能,并诱导MC38(抗PD-1敏感)和B16-F1(肿瘤浸润淋巴细胞匮乏,抗PD-1不敏感)小鼠模型中的肿瘤生长抑制。
NO15~AZD4573
AZD4573,是一种适用于静脉给药的CDK9抑制剂,设计用于人体中短暂的靶向结合。该产品对CDK9的短暂抑制提供了一种间接下调关键细胞存活蛋白(如Mcl-1)以杀死肿瘤细胞的机制。在生物化学测定试验(FRET)中,AZD4573对CDK9具有高效抑制作用,且对所有其他测试的CDK和激酶具有选择性。在小鼠异种移植研究中,AZD4573在MM、AML和NHL模型中引起持久的消退。根据Clinical Trials官网,阿斯利康已登记开展了多项AZD4573的临床试验,其中包括:已完成的一项在复发或难治性血液学恶性肿瘤受试者中进行的1期试验;正在开展的AZD4573联合Acalabrutinib治疗晚期血液恶性肿瘤患者的1/2期研究;以及AZD4573单药或联合抗癌药物治疗复发/难治性外周T细胞淋巴瘤或经典霍奇金淋巴瘤患者的2期研究。
NO16~LY3437943
LY3437943,是礼来在研的一款GIPR/GLP-1R/GCGR三靶点激动剂。此前披露的临床前数据表明,在肥胖糖尿病小鼠模型中,LY3437943表现出比GLP-1RA更强的血糖控制和体重减轻作用。2021年ADA披露了LY3437943在健康受试者中首次进行人体给药研究的数据,研究显示单次给药后LY3437943的平均终末半衰期为134~165h,支持每周1次给药;同时,观察到其安全性、耐药性特征与其他肠促胰素药物类似。
NO17~Vamorolone
Vamorolone,是一款“first-in-class”类固醇药物,它与普通类固醇药物的区别在于,能够有选择性地激活类固醇的某些信号通路;在保持类固醇对杜氏肌营养不良症疗效的同时,减少副作用的产生。2023年10月美国FDA批准了Vamorolone口服混悬液40 mg/mL的上市申请,用于治疗2岁及以上杜氏肌营养不良患者。
NO18~RO7434656
RO7434656注射液,是罗氏在研的反义疗法,是一款靶向补体因子B(CFB)的反义疗法,旨在从源头上阻止IgA肾病患者因补体活化导致的肾损伤;国内临床试验申请获得默认许可,适应症为IgA肾病。
NO19~Redasemtide
Redasemtide,是一种处于研发阶段的再生诱导药物,通过使用一种药物而不是使用活细胞,来再生因损伤或疾病而受损的组织。2021年12月,日本药企盐野义公布了再生诱导药物S-005151(Redasemtide)治疗急性缺血性卒中(AIS)患者2期临床试验的阳性结果。该试验中,Redasemtide治疗组和安慰剂组的不良事件发生率相似,证实了Redasemtide的良好耐受性。
NO20~Eplontersen
Eplontersen,为一款一月一次可由患者自己皮下注射的在研反义寡核苷酸药物,其采用的反义寡核苷酸配体偶联(LICA)技术,可以将ASO药物与能和细胞表面特定受体结合的配体分子偶联在一起。LICA技术能有效地将ASO选择性递送到表达这些受体的细胞中。Eplontersen可用以抑制TTR蛋白的生产,从而治疗遗传性与非遗传性的淀粉样变性多发性神经病。此药已获得美国FDA授予孤儿药资格。2023年12月阿斯利康宣布美国FDA已批准反义寡核苷酸(ASO)疗法Eplontersen(商品名:Wainua)上市,用于治疗成人遗传性转甲状腺素蛋白(TTR)介导的淀粉样变性的多发性神经病(ATTRv-PN)。
NO21~EYP-1901
EYP-1901,是将伏罗尼布和Durasert技术相结合,形成的一种新的治疗方案,可在门诊注射使用,实现至少6个月的药物释放。该技术可以使药物以一种可控和可耐受的方式持续地在眼部释放,延长注射治疗周期,提高患者治疗依从性,减轻医疗负担,并最终改善患者临床效果。2022年2月,贝达子公司Equinox曾与EyePoint签署了《独占许可协议》,独家授权EyePoint在中国区域外以局部给药方式开发伏罗尼布;后者在其递送技术基础上开发了EYP-1901。2022年5月,贝达与EyePoint签署《扩大许可协议》并修订了《独占许可协议》,取得在中国区域开发和商业化EYP-1901的独家权利。
NO22~Aficamten
Aficamten,是一种在研口服、选择性小分子心肌肌球蛋白抑制剂,旨在减少每个心动周期期间活性肌动蛋白-肌球蛋白桥联的数量,从而抑制与肥厚型心肌病相关的心肌过度收缩。细胞动力科技公司公布了Aficamten在症状性梗阻性肥厚型心肌病患者中进行的关键3期临床试验SEQUOIA-HCM的积极结果。结果表明,与安慰剂相比,使用新一代选择性心肌肌球蛋白抑制剂Aficamten可显著提高患者的运动能力,并且在所有10个预先指定的次要终点中也观察到具有统计学意义和临床意义的改善。
NO23~Olorofim
Olorofim,是F2G公司开发的一款全新机制的抗真菌感染药物,通过抑制嘧啶合成途径中的二氢乳清酸脱氢酶来杀死真菌细胞。Olorofim是唯一被FDA授予突破疗法资格的抗真菌药物,代表了过去20年来开发的第一个新型抗真菌药物。2022年5月,盐野义与F2G公司达成合作,以4.8亿美元的总交易额获得该产品在欧洲和亚洲的商业化权益。
NO24~TAK-676
TAK-676,是武田开发的一种新型合成STING激动剂,与瘤内注射STING激动剂相比,TAK-676可降低血清降解并增强渗透性,允许全身性静脉给药。此外,在放疗后使用TAK-676可通过增加STING介导的IFN抑制剂释放来增强免疫应答,并进一步刺激T细胞介导的抗肿瘤免疫反应。武田已在美国开展多项I期临床研究,旨在探索放疗后TAK-676联合帕博利珠单抗在实体瘤患者中安全性和初步抗肿瘤活性。
NO25~ABX464
Obefazimod(ABX464),是一款口服、具有“first-in-class”潜力治疗溃疡性结肠炎的小分子药物,它能够通过上调一种独特的RNA剪接产物和抗炎因子miR-124的表达,进而抑制许多炎症反应介导物的生产,并在临床试验中显示出使UC患者缓解和“治愈”炎症病变的能力。CDE官网公示,Abivax公司申报的1类新药Obefazimod获得临床试验默示许可,拟用于治疗中度至重度溃疡性结肠炎患者。
NO26~Sisunatovir
Sisunatovir,是一种辉瑞开发的口服融合抑制剂,旨在通过抑制由F蛋白介导的病毒与宿主细胞的融合,以阻断RSV复制。临床前试验显示:Sisunatovir具有出色的安全性和极具吸引力的治疗指标。在1期临床试验中,Sisunatovir达到了目标人体暴露水平,且未发生任何严重不良反应。2022年4月,辉瑞斥资5.25亿美元通过收购ReViral将Sisunatovir纳入囊中。2022年12月,辉瑞与联拓生物达成战略合作,又从联拓生物手中获得Sisunatovir在中国大陆、香港、澳门和新加坡地区的开发和商业化权利。
NO27~MK-0616
MK-0616,是由默克公司发现和开发的一种在研的、可能是首 个口服PCSK9抑制剂,旨在降低低密度脂蛋白胆固醇。MK-0616是一种大环肽,可结合PCSK9并抑制PCSK9与LDL受体的相互作用,旨在通过抑制PCSK9增加LDL-C在血液中的清除。CDE官网公示,默沙东在中国启动了一项针对成人高胆固醇血症的名为“MK-0616”的口服PCSK9抑制剂的III期临床试验,这是默沙东“MK-0616”国际多中心临床试验的中国研究。
NO28~INCB099280
INCB099280,是一种选择性的小分子口服PD-L1抑制剂,已在实体瘤患者中显示出良好的临床活性和安全性。根据Clinical Trials官网,目前INCB099280正在开展多项临床试验,包括:联合CTLA-4抑制剂伊匹木单抗治疗某些实体瘤的1期研究;治疗晚期皮肤鳞状细胞癌患者的2期研究;治疗免疫检查点抑制剂阴性的选定实体瘤的2期研究等。
NO29~Zipalertinib
Zipalertinib,是一种新型的、不可逆的口服EGFR抑制剂,具有广谱EGFR突变活性(包括EGFR 20外显子插入突变);与野生型EGFR相比,对EGFR 20外显子插入突变型的抑制具有高选择性,这表明与目前批准或正在开发的大多数EGFR酪氨酸激酶抑制剂相比,Zipalertinib可能具有更宽的临床治疗窗口。
NO30~ODM-208
ODM-208,是Orion公司发现和开发的一款CYP11A1特异性口服非类固醇抑制剂,用于治疗激素依赖性的癌症,比如前列腺癌。通过抑制CYP11A1酶的活性,ODM-208可以抑制所有类固醇激素和可能激活雄激素受体(AR)信号通路的激素前体的产生。这与AR配体结合域(LBD)激活体细胞点突变的患者尤其相关,体细胞点突变是mCRPC中对激素治疗的抵抗机制之一。默沙东正在和Orion公司合作开发,该产品目前正在2期临床试验中用于治疗转移性去势抵抗性前列腺癌。
NO31~LOXO-435
LOXO-435,是礼来开发的一款有效且具有高度亚型选择性的FGFR3抑制剂,对FGFR3 gatekeeper抗性突变具有活性。LOXO-435可避免因抑制FGFR1和FGFR2导致的剂量限制性毒性,即出现高磷酸血症和其他慢性不耐受的不良事件。目前,该产品正在国外开展尿路上皮癌I期临床研究,全球尚没有FGFR3抑制剂获批上市。国内进入临床的同靶点药物有Recifercept(重组FGFR3,辉瑞)和SAR442501(FGFR3单抗,赛诺菲)。
NO32~CFT8919
CFT8919,是一种BiDAC降解剂,旨在有效和选择性地对抗EGFR L858R,从而治疗NSCLC患者。贝达药业通过一项近4亿美元的合作,获得了在大中华区开发、制造和商业化CFT8919的权益。CDE官网公示,C4 Therapeutics递交的1类新药CFT8919片已获得临床试验默示许可,拟开发用于治疗携带EGFR突变的局晚期或晚期非小细胞肺癌患者。
NO33~RZL-012
RZL-012,其作用机制是首先使注射部位脂肪坏死,随后发生一过性炎症反应,最后纤维化组织替代先前的脂肪组织,逐渐愈合。该分子已在美国完成多项临床试验,减少颏下脂肪(SMF)适应症的多项II期临床研究结果证实了RZL-012疗效显著,且由于该化合物的化学特性,使其与脂肪细胞具有恰到好处的亲和力,在注射后疼痛轻微、恢复期短、疗效持久,可极大满足求美者和医生的临床需求。目前,复锐医疗已从以色列Raziel Therapeutics公司获得了该品种的大中华区开发权益并报CDE,临床拟用于“减少颏下脂肪凸起”的美学适应症。
NO34~LY3537982
LY3537982,是礼来开发的新一代KRAS G12C特异性抑制剂,已被证明在体外靶向KRAS G12C突变,从而抑制KRAS依赖性突变信号。在临床前模型中,它显示了作为单一疗法和与其他抗癌疗法联合使用的活性。于我国国内,该品种的拟定适应症为:联合帕博利珠单抗或联合帕博利珠单抗、培美曲塞和铂类治疗KRAS G12C突变的晚期非小细胞肺癌。
NO35~TAK-279
TAK-279(Zasocitinib),是一种口服高选择性TYK2抑制剂,与JAK1相比,对TYK2的选择性高出约130万倍。TAK-279有潜力成为一种重要的治疗方法,开发用于多种免疫介导的炎症性疾病。2022年12月,武田宣布将从Nimbus收购Zasocitinib(NDI-034858),预付款为40亿美元,并将在实现40亿美元和50亿美元的年净销售额后,分别支付两笔10亿美元的里程碑付款。
NO36~BAY3283142
BAY3283142,是一款可溶性鸟苷酸环化酶(sGC)激动剂,作用机制是激活sGC,产生cGMP,后者能放松血管,从而对慢性肾病有好处。拜耳此前已就该药完成了三项1期研究,于我国国内获批临床默示许可,拟开发治疗慢性肾脏病。
NO37~Baxdrostat
Baxdrostat,是一种新型的醛固酮合成酶抑制剂(ASI),拟开发用于难治性高血压的降压等适应症。该候选药可选择性靶向由CYP11B2基因编码的醛固酮合成酶,同时对11?-羟化酶的阻断活性的亲和力低得多。在临床前和1期研究中,Baxdrostat对醛固酮合酶抑制显示出具有100:1的选择性,并且多个剂量水平的Baxdrostat降低血浆醛固酮水平,但不降低皮质醇水平。2023年2月,研究人员在《新英格兰医学杂志》(NEJM)上发表了Baxdrostat治疗难治性高血压患者的2期临床试验数据。研究结果显示:接受Baxdrostat治疗的难治性高血压患者的血压出现了剂量相关的降低。
NO38~AZD3470
AZD3470,是一款特异性靶向甲基硫代腺苷(MTA)和蛋白质精氨酸甲基转移酶5(PRMT5)复合物的新一代PRMT5抑制剂,作为一类新兴的抗肿瘤药物,也是继PARP抑制剂之后下一波有潜力的“合成致死”疗法之一;该品种拟开发治疗MTAP缺陷型晚期/转移性实体瘤。公开资料显示,第一代基于SAM和(或)底物进行设计PRMT5抑制剂的毒性较大,安全窗口窄。因此,行业正在开发新一代PRMT5抑制剂,以期选择性抑制MTAP缺失的细胞而不影响正常的细胞,提高药物的安全性。
NO39~HRO761
HRO761,是诺华在研的一款靶向WRN的口服药物。根据研究人员在2023年美国癌症研究协会(AACR)年会上公布的临床前研究结果,每日口服HRO761在CDX和PDX模型中均显示出有效性,所有适应症的疾病控制率均为70%。HRO761还以剂量依赖的方式诱导WRN降解,激活DNA损伤反应并诱导p53靶基因。体外联合伊立替康可加深对HRO761的敏感性,并在MSI-H结直肠癌细胞系中获得更持久的应答。该品种拟用于单药或联合替雷利珠单抗或伊立替康,用于微卫星高度不稳定型或错配修复缺陷型肿瘤,以评估该产品的安全性、推荐剂量以及初步抗肿瘤活性。
NO40~Zetomipzomib
Zetomipzomib(泽托佐米),是一种新型、一流的选择性免疫蛋白酶体抑制剂,治疗一系列免疫介导疾病的效果,包括狼疮性肾炎。临床前研究表明,选择性免疫蛋白酶体抑制可在多种自身免疫性疾病的动物模型中产生广泛的抗炎反应,同时避免免疫抑制。Zetomipzomib泽托佐米在治疗严重慢性自身免疫性疾病方面表现出良好的安全性和耐受性。
NO41~Camonsertib
Camonsertib,是Repare开发的ATR小分子抑制剂,通过检查点激酶1(CHK1)的磷酸化对复制应激(RS)进行反应,使其在S?G2和M阶段触发细胞周期阻滞,从而抑制由ATR激酶介导的修复通路,高效杀死肿瘤细胞。
NO42~SAR441566
SAR441566,是效力可与抗体媲美的口服TNFR1信号通路抑制剂,通过扭曲可溶性TNFα三聚体的构象,阻断TNFα与TNFR1的相互作用,然而它不会影响与细胞膜结合的TNFα的信号传导,从而降低感染风险并提高疗效。在治疗银屑病的1b期临床试验中,它在改善症状的同时表现出良好的安全性和耐受性,目前已在2期临床试验中用于治疗银屑病和类风湿性关节炎。
NO43~Cemdisiran
Cemdisiran,是RNAi治疗药物,针对补体途径的末端补体成分5(C5),与N-乙酰半乳糖胺(GalNAc)配体结合,可用于治疗补体介导的疾病。在皮下给予Cemdisiran后,GalNAc配体部分与肝细胞上表达的去唾液酸糖蛋白受体(ASGPR)特异性结合并被其吸收。在细胞内,siRNA与C5 mRNA结合,从而抑制C5蛋白的翻译和表达,补体系统作为宿主防御的保护机制在免疫中发挥核心作用,但其失调会导致多种人类疾病出现危及生命的并发症,包括阵发性睡眠性血红蛋白尿、非典型溶血性尿毒症综合征、重症肌无力、视神经脊髓炎和膜性肾病等。
NO44~Etavopivat
Etavopivat,据诺和诺德官网介绍,正在被开发用于治疗镰状细胞贫血病(SCD)。作为一款在研、一天一次的选择性PKR激动剂,Etavopivat可通过活化红细胞内天然的PKR进而降低红细胞内无氧糖酵解产物2,3-DPG的含量,使得细胞能够携带更多氧气、增加腺苷三磷酸(ATP)产量,并减少溶血与镰状细胞的产生。在此前于海外开展的1期临床试验中,Etavopivat已展现良好的耐受性,并显示出具有改善红细胞健康、增加血红蛋白含量、减少病患复发性血管闭塞危象(VOC)症状与改善患者生活品质的潜力。该药曾获得美国FDA授予的快速通道资格、罕见儿科疾病认定与孤儿药资格,以及欧盟委员会(EC)授予的孤儿药资格。
表1 2023年首次受理的1类化药进口IND品种
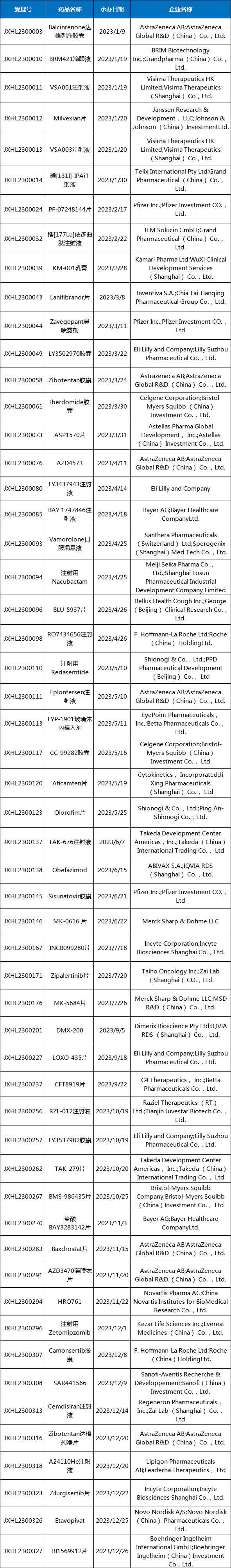
注:表格数据为笔者手动统计,如有错误及纰漏,还请指正。
参考来源:药智数据、各家企业官网、各家企业官微



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57