Part 1
国内仿制药研发批准动态
01
新注册分类品种首家批准上市情况
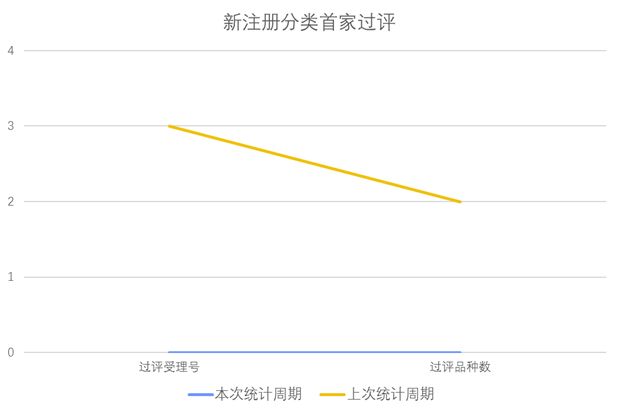
根据药渡数据调研,本次统计周期(2024.03.23-03.29)无新增新注册分类首家过评受理号。与上次统计周期相比,本次减少2个新注册分类首家过评品种。
02
一致性评价品种首家批准上市情况
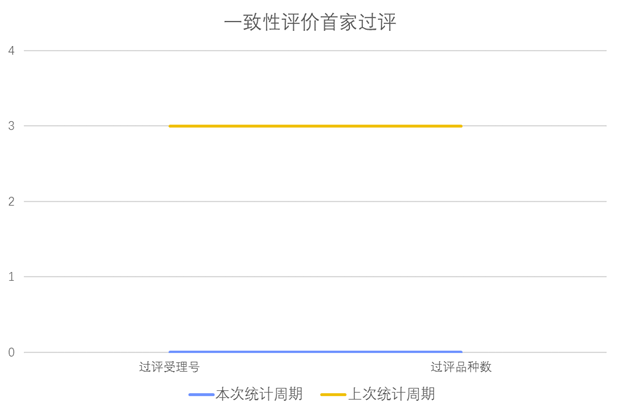
根据药渡数据调研,本次统计周期(2024.03.23-03.29)无新增一致性评价首家过评受理号。与上次统计周期相比,本次减少3个一致性评价首家过评品种。
03
新注册分类品种批准上市情况
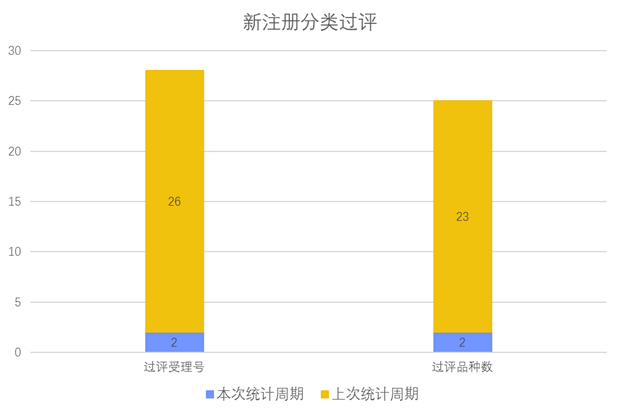
根据药渡数据调研,本次统计周期(2024.03.23-03.29)新注册分类新增2个过评受理号,涉及2个品种,包括2个片剂。与上次统计周期相比,本次减少21个新注册分类过评品种。
新注册分类品种过评情况

04
一致性评价品种批准上市情况
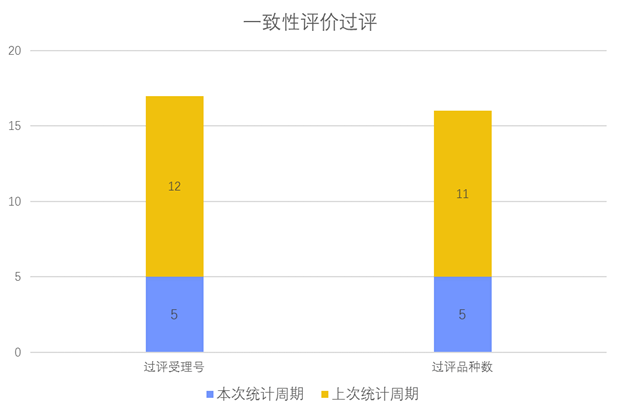
根据药渡数据调研,本次统计周期(2024.03.23-03.29)一致性评价新增5个过评受理号,涉及5个品种,包括1个口服散剂,2个片剂,2个注射剂。与上次统计周期相比,本次减少6个一致性评价过评品种。
一致性评价品种过评情况
盐酸多奈哌齐片
盐酸多奈哌齐是由日本卫材株式会社开发的一款AChE抑制剂。目前主流研究认为阿尔茨海默病痴呆症状的发病机制部分与胆碱能神经传递功能的低下有关。盐酸多奈哌齐可能通过增强胆碱能神经的功能发挥治疗作用,可逆性地抑制乙酰胆碱酯酶对乙酰胆碱的水解,从而提高乙酰胆碱的浓度,临床上用于轻度、中度或重度阿尔茨海默病症状的治疗。
盐酸多奈哌齐最早于1996年11月获FDA批准在美国上市,1999年10月获PMDA批准在日本上市,2001年NMPA批准在国内上市。目前盐酸多奈哌齐在售剂型共有4种,包括普通片剂、口腔崩解片、分散片和口腔速溶膜。国内市场主力销售剂型为盐酸多奈哌齐片。根据药渡数据-仿制药库调研,包括原研企业卫材在内,国内共有10家企业拥有盐酸多奈哌齐片的生产批文。
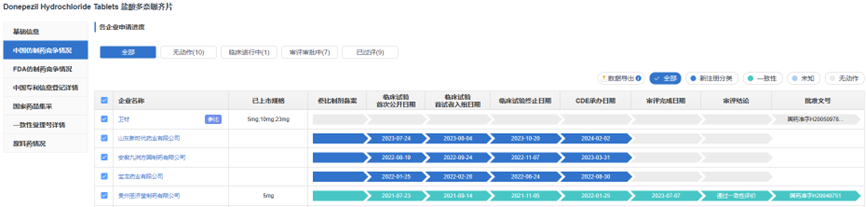
篇幅原因,仅展示前五家企业申报进展情况,更多信息,请查看药渡数据-仿制药库
根据药渡数据-中国注册库统计信息显示,目前国内盐酸多奈哌齐片的申报格局为“5+12”,过评格局为“5+4”。过评详细信息如下:
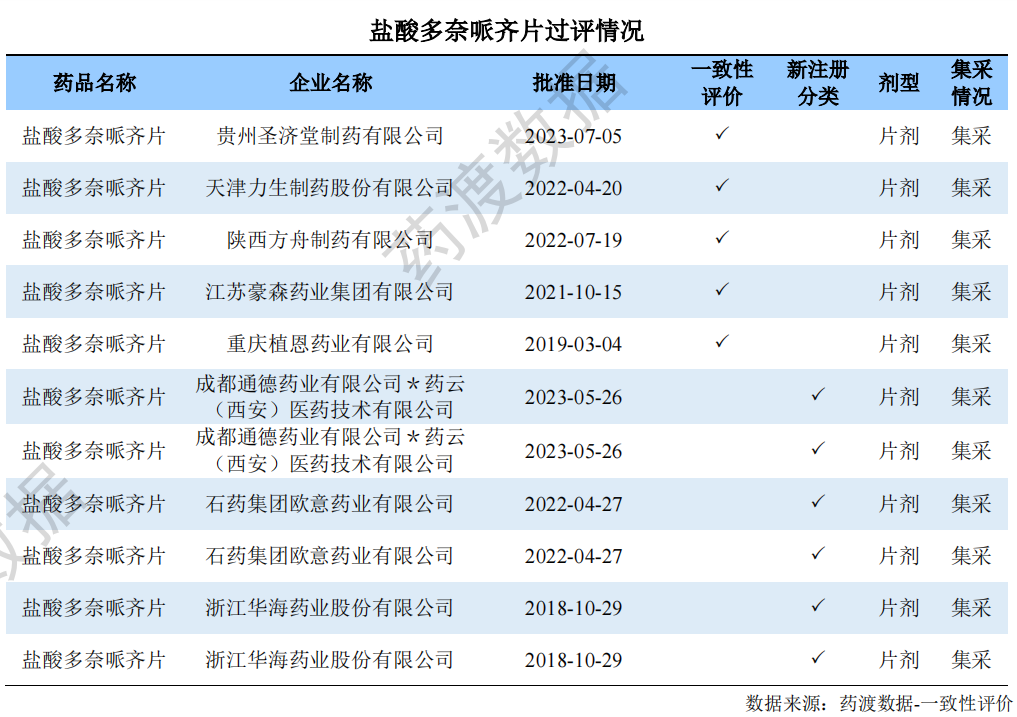
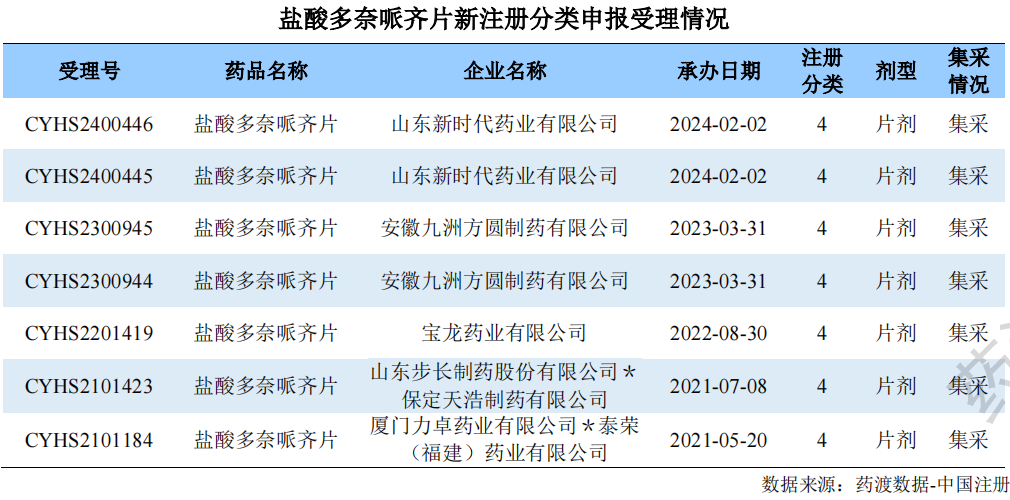
此外,除去未获批件的企业之外,尚有7家新4类报产申请在审评审批中。
药渡数据-中国销量库统计数据显示,盐酸多奈哌齐片在2020年前,已经突破9亿元大关。2019年底计入集采目录后,单价大幅降低,几年来销量却逆势上扬,2022年以3.1亿元完 美收官。然而,目前国内市场6成以上的市场份额由原研企业卫材所占据。
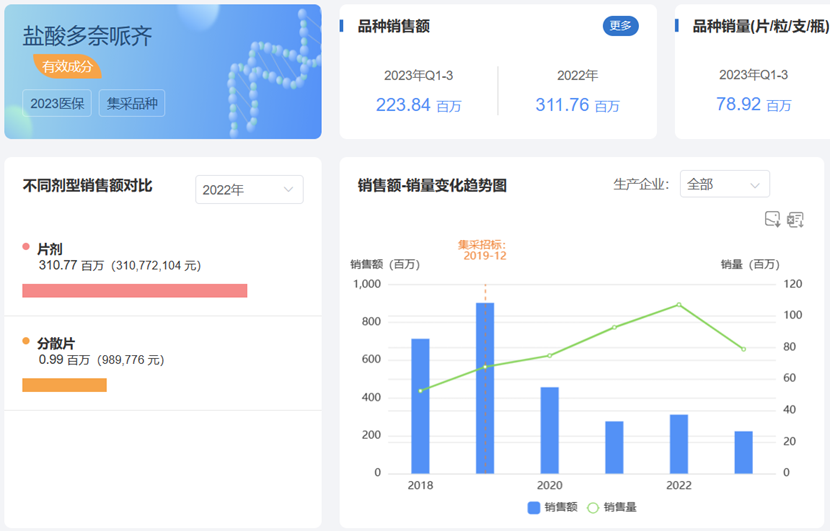
随着全球老龄化社会进程的无法阻挡,并且叠加当前缺乏有效用药、患者数量庞大、疾病预后较差等多方因素影响,阿尔茨海默病的治疗仍有巨大的临床需求尚未满足。有关统计数据显示,美国阿尔茨海默治疗等投入每年要消耗掉2700多亿美元,折合人民币超过1.8万亿元,中国市场也不容小觑。此次重庆锐恩医药进入这片蓝海,将为国内阿尔茨海默患者带来更多的治疗选择。
05
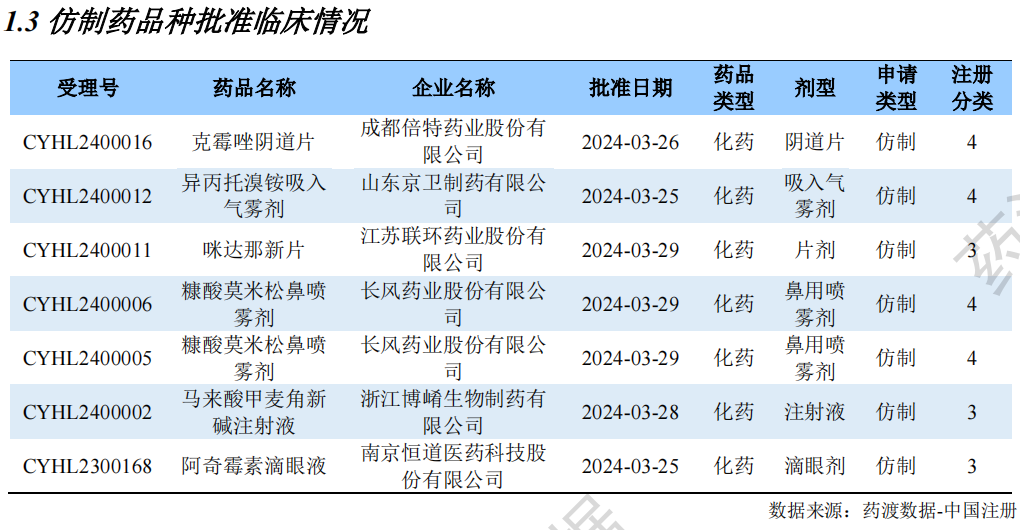
仿制药品种批准临床情况
Part 2
国内仿制药研发批准动态
01
新注册分类品种申报上市情况
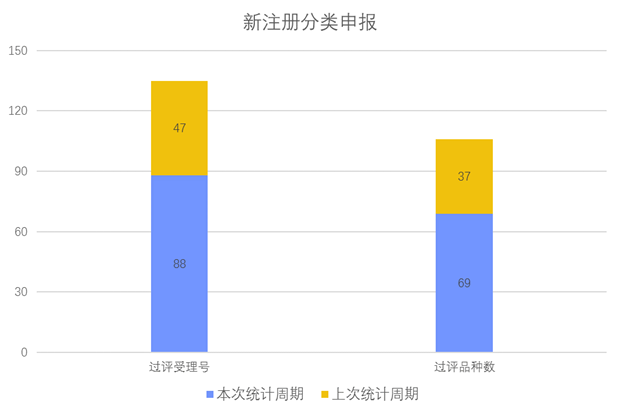
根据药渡数据调研,本次统计周期(2024.03.23-03.29)新注册分类数据新增88个新报受理号,涉及69个品种,包括1个搽剂,1个滴剂,4个滴眼剂,2个混悬液,4个胶囊剂,2个颗粒剂,6个口服溶液剂,21个片剂,1个乳膏剂,2个软膏剂, 1个吸入溶液剂,24个注射剂。与上次统计周期相比,本次增加32个新注册分类申报品种。
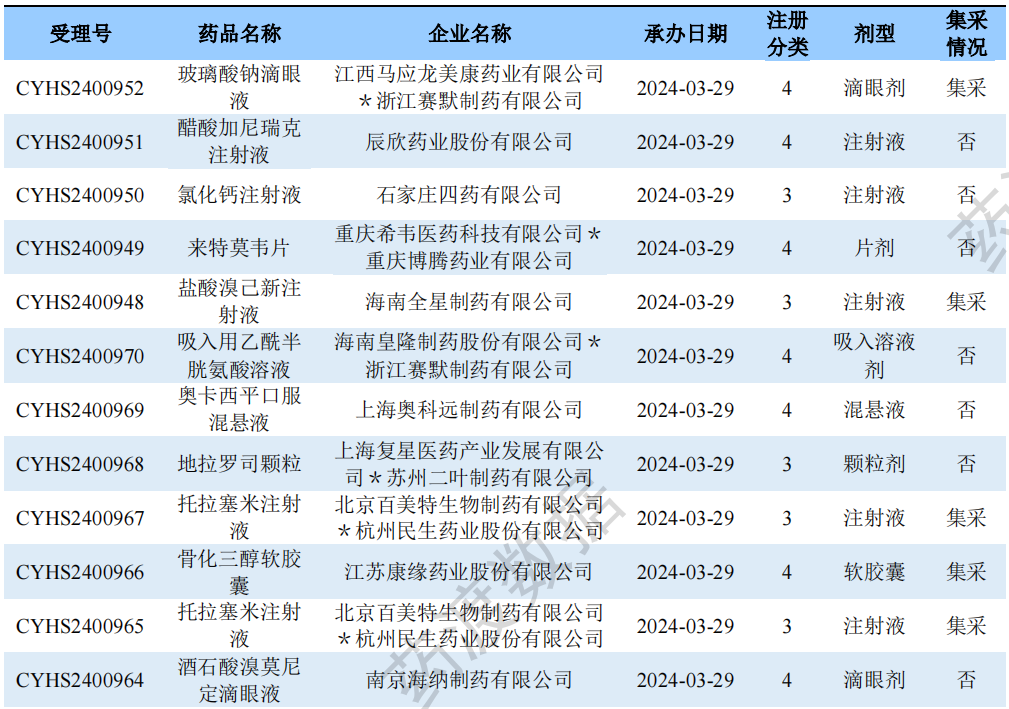
新注册分类品种申报受理情况(部分)
02
一致性评价品种申报上市情况
根据药渡数据调研,本次统计周期(2024.03.23-03.29)一致性评价数据新增9个新报受理号,涉及5个品种,包括1个胶囊剂,1个片剂,3个注射剂。与上次统计周期相比,本次减少1个一致性评价申报品种。
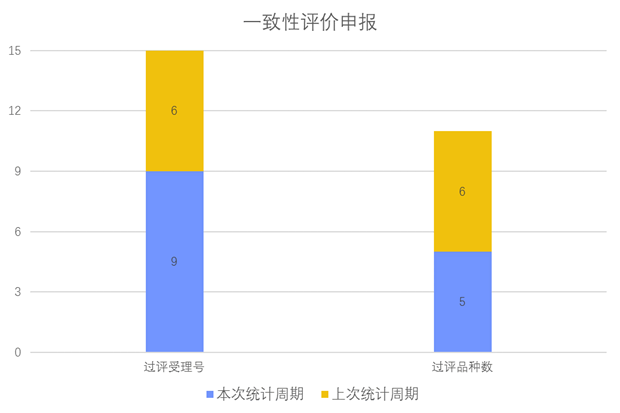
一致性评价申报受理情况
03
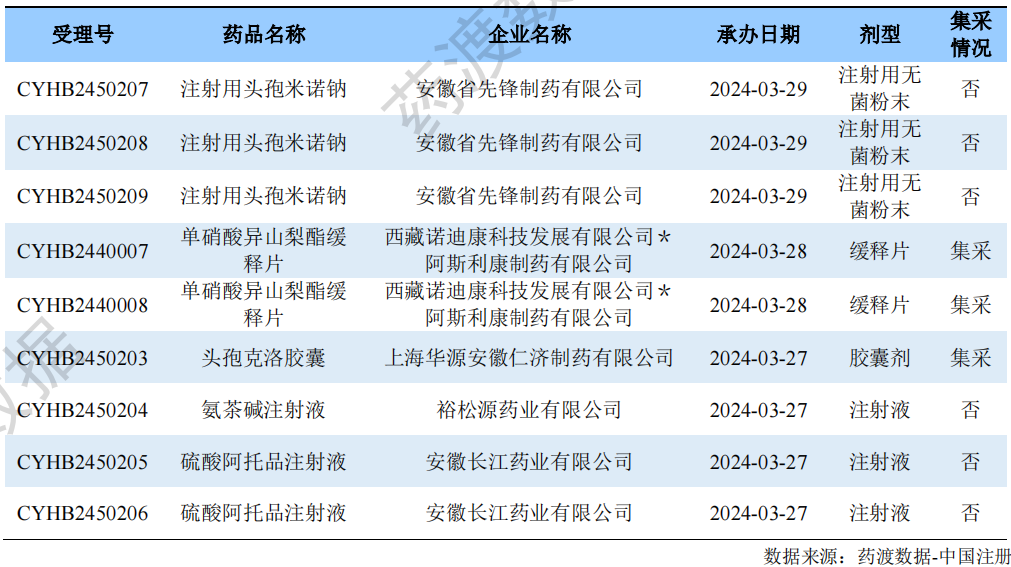
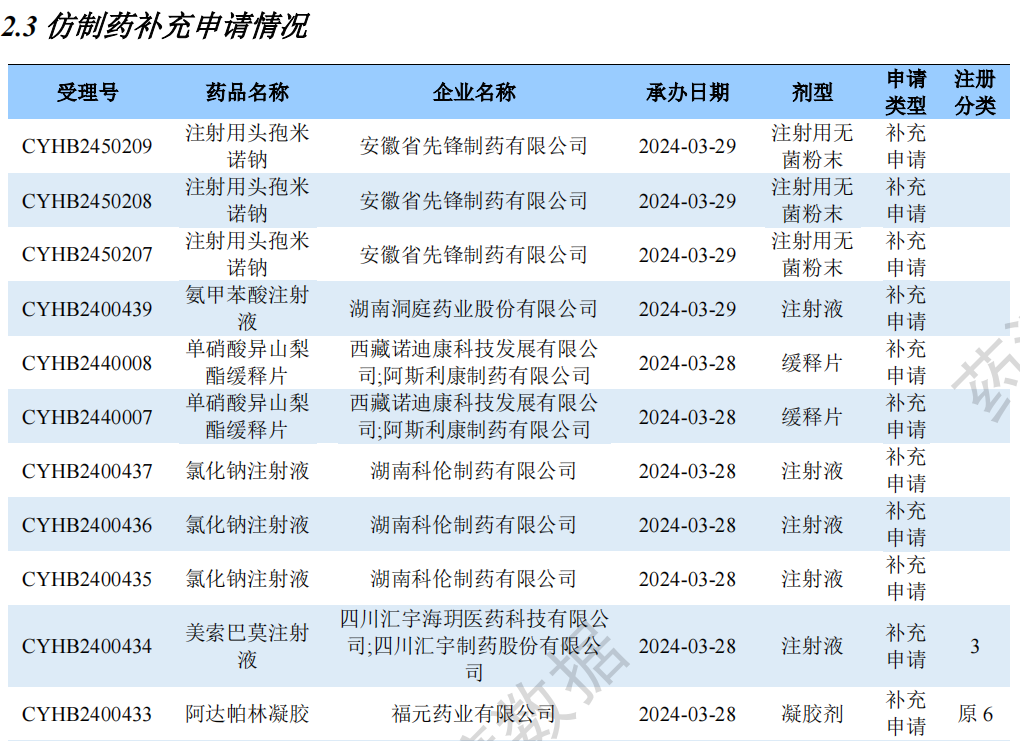
仿制药补充申请情况
04
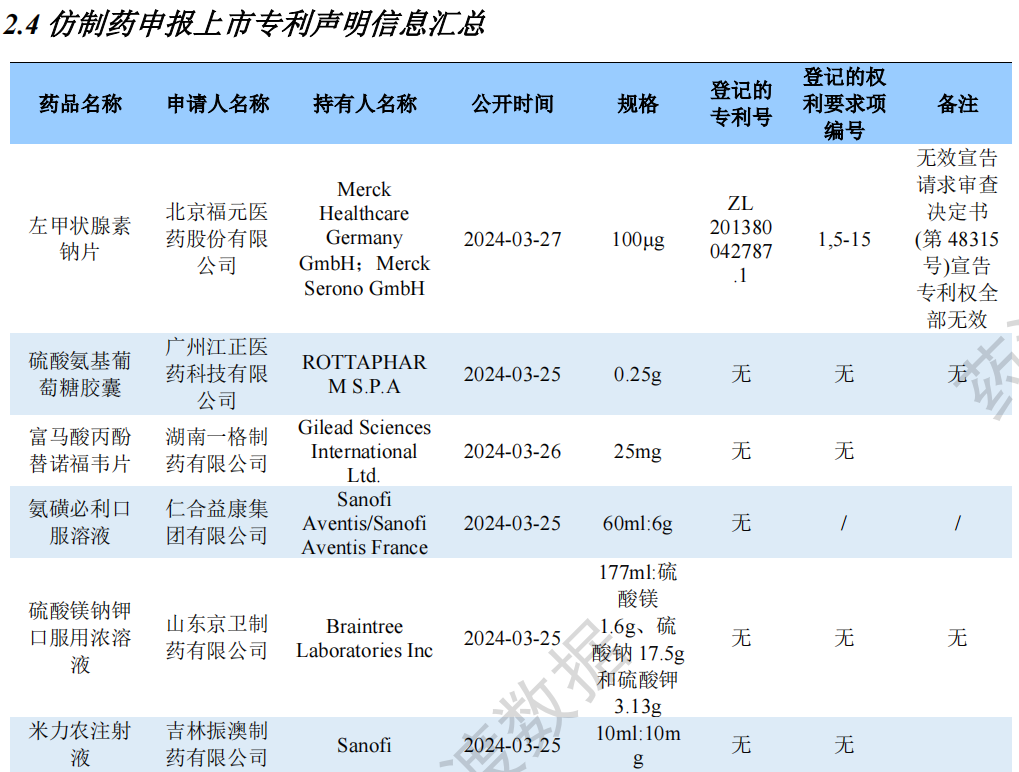
仿制药申报上市专利声明信息汇总
Part 3
国内仿制药研发领域热点聚焦
01
国内仿制药研发领域政策法规相关动态
国家药监局关于七叶皂苷钠搽剂处方药转换为非处方药的公告(2024年第30号)
根据《处方药与非处方药分类管理办法(试行)》(原国家药品监督管理局令第10号)的规定,经国家药品监督管理局组织论证和审核,七叶皂苷钠搽剂由处方药转换为非处方药。品种名单及其非处方药说明书范本一并发布。
请相关药品上市许可持有人在2024年12月20日前,依据《药品注册管理办法》等有关规定,向省级药品监督管理部门提交修订说明书备案,并将说明书修订内容及时通知相关医疗机构、药品经营企业等单位。
非处方药说明书范本规定内容之外的说明书其他内容按原批准证明文件执行。药品标签涉及相关内容的,应当一并修订。药品上市许可持有人提交备案之日起生产的药品,不得继续使用原药品说明书。特此公告。
02
国内仿制药研发领域热点新闻
天士力:士力关于全资子公司药品尼可地尔片通过仿制药一致性评价的公告
2024 年3月29日,天士力医药集团股份有限公司发布公告称,全资子公司江苏天士力帝益药业有限公司于近日收到国家药品监督管理局颁发的关于尼可地尔片的《药品补充申请批准通知书》,批准该药品通过仿制药质量和疗效一致性评价。现将相关情况公告如下:
一、药品的基本情况
药品名称:尼可地尔片
剂型:片剂
规格:5mg
注册分类:化学药品
原药品批准文号:国药准字 H32025656
通知书编号:2024B01279
上市许可持有人:江苏天士力帝益药业有限公司
药品生产企业:江苏天士力帝益药业有限公司
审批结论:根据《中华人民共和国药品管理法》、《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44 号)和《关于仿制药质量和疗效一致性评价工作有关事项的公告》(2017 年第 100 号)的规定,经审查,本品通过仿制药质量和疗效一致性评价。
二、药品的相关信息
尼可地尔片用于治疗心绞痛,为《国家基本医疗保险、工伤保险和生育保险 药品目录(2023 年)》甲类品种。公司尼可地尔片一致性评价申请于 2023 年 6 月 12 日获得 CDE 受理(受理号:CYHB2350487),并于近日获得国家药监局核准 签发的《药品补充申请批准通知书》。截至目前,江苏帝益针对该药品一致性评价的累计研发投入为 1,168.80 万元人民币。
尼可地尔原研药由中外制药株式会社持有,1983年尼可地尔片剂在日本上市,2005 年批准进入中国市场。截至本公告日,中国境内尼可地尔片的主要生产厂家有中外制药、西安汉丰药业、天方药业、山西鑫煜制药等,包括帝益药业在内共有 3 家通过仿制药一致性评价。根据相关网数据显示,2022 年尼可地尔在国内城市公立、县级公立医院的销售额为人民币 18.18 亿元。
三、风险提示
公司尼可地尔片通过仿制药一致性评价,有利于提升该药品市场竞争力。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57