Part 1
国内仿制药研发批准动态
01
新注册分类品种首家批准上市情况
根据药渡数据调研,本次统计周期(2024.03.30-04.05)新增1个新注册分类首家过评受理号,涉及1个颗粒剂。与上次统计周期相比,本次增加1个新注册分类首家过评品种。
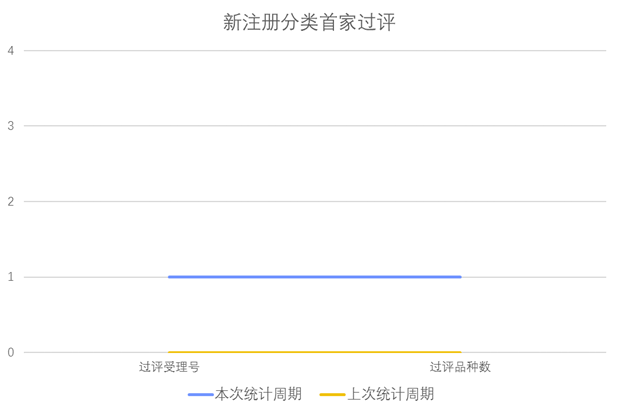
新注册分类品种首家批准上市情况

02
一致性评价品种首家批准上市情况
根据药渡数据调研,本次统计周期(2024.03.30-04.05)新增1个一致性评价首家过评受理号,涉及1个颗粒剂。与上次统计周期相比,本次增加1个一致性评价首家过评品种。
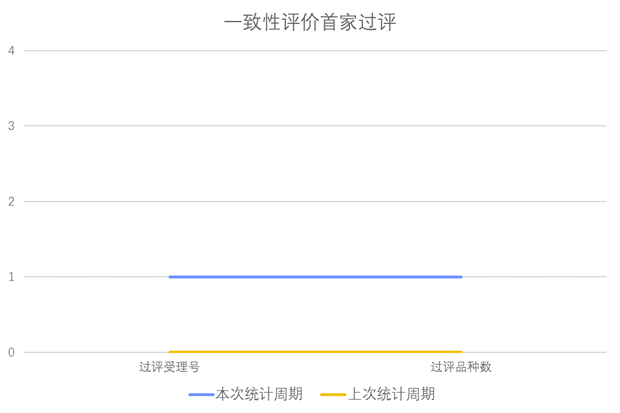
一致性评价品种首家批准上市情况

03
新注册分类品种批准上市情况
根据药渡数据调研,本次统计周期(2024.03.30-04.05)新注册分类新增23个过评受理号,涉及19个品种,包含1个干混悬剂,1个颗粒剂,1个口服溶液剂,8个片剂,2个吸入溶液剂,6个注射剂。与上次统计周期相比,本次增加17个新注册分类过评品种。
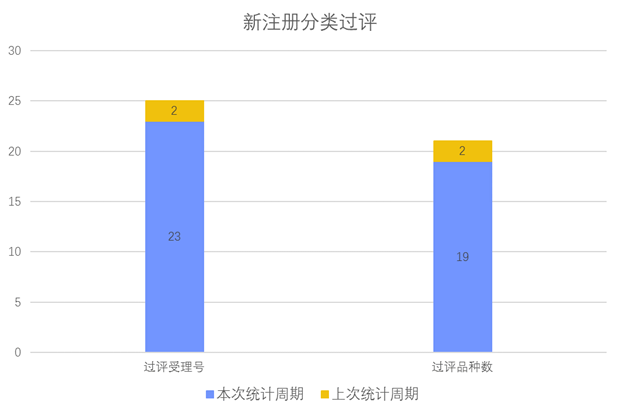
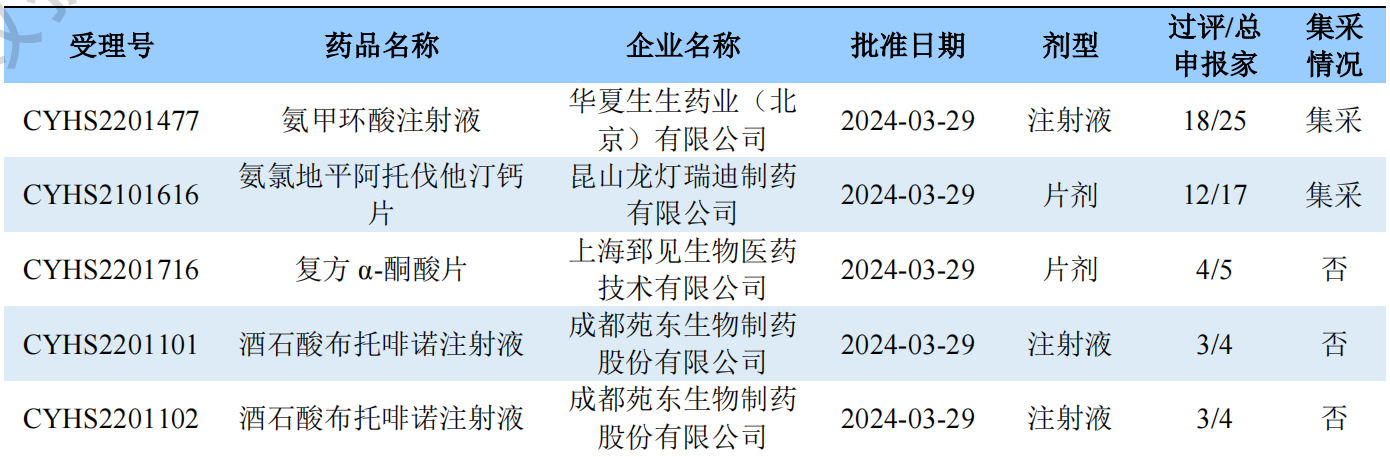
新注册分类品种过评情况(部分)
04
一致性评价品种批准上市情况
根据药渡数据调研,本次统计周期(2024.03.30-04.05)一致性评价新增12个过评受理号,涉及10个品种,包括1个颗粒剂,4个片剂,5个注射剂。与上次统计周期相比,本次增加5个一致性评价过评品种。
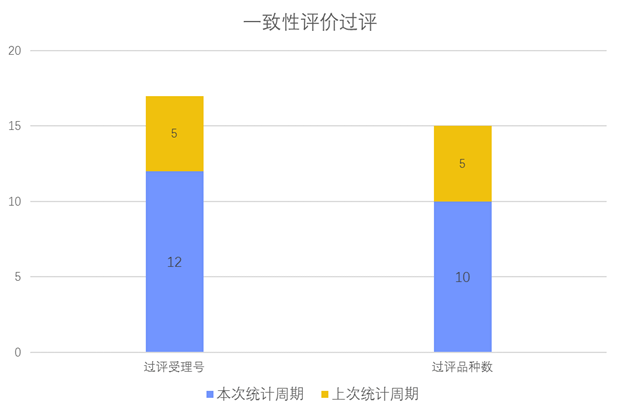
一致性评价品种过评情况(部分)
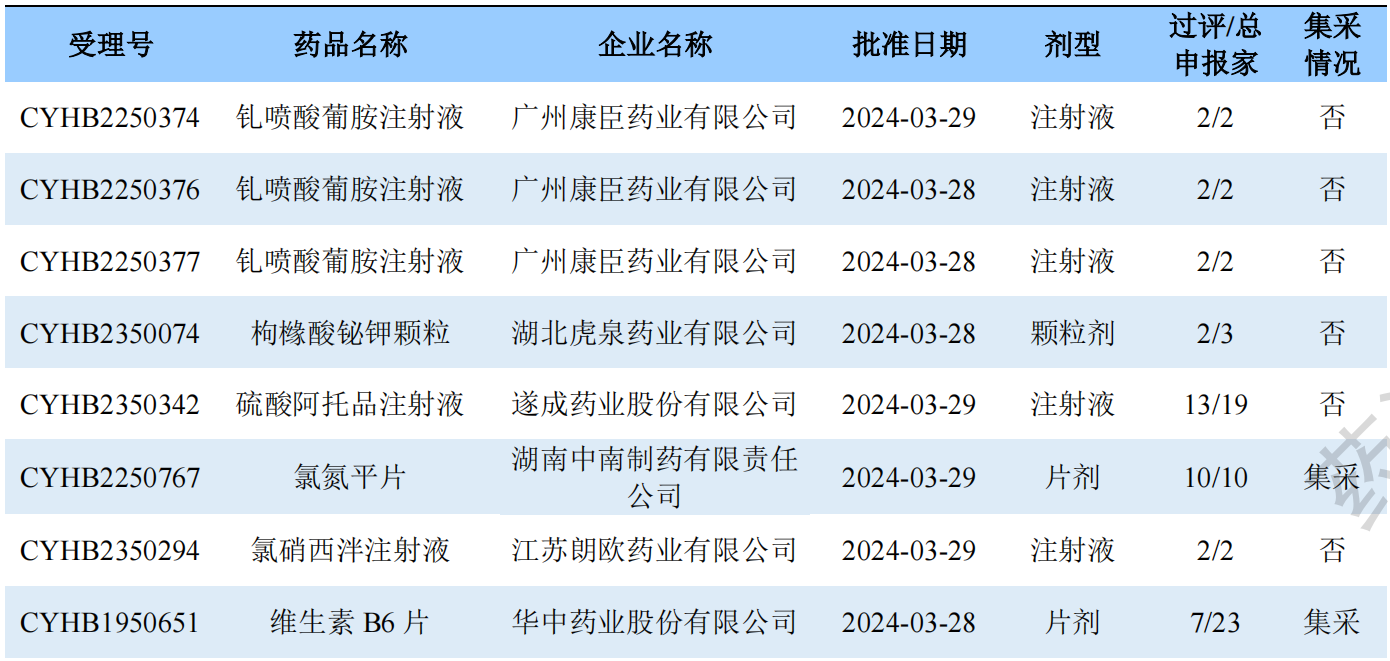
钆喷酸葡胺注射液
钆喷酸葡胺注射液是拜耳开发的一款磁共振造影剂,主要用于中枢神经(脑及脊髓)、腹、胸、盆腔、四肢等人体脏器和组织的磁共振成像。钆喷酸葡胺注射液最早于1988年获FDA批准在美国上市,1995年经NMPA批准在国内上市,由广州康臣药业负责销售。
根据药渡数据-仿制药库调研,包括原研企业拜耳在内,国内共有4家企业拥有钆喷酸葡胺注射液的生产批文。其中北京北陆制药于2021年7月通过一致性评价审评,成为该品种的“首家”过评企业。

药渡数据-中国注册库信息显示,国内钆喷酸葡胺注射液的申报格局为“2+3”,过评格局为“2+0”。除了首仿企业北京北陆制药,广东康辰药业此次加入钆喷酸葡胺注射液的一致性评价过评阵营,成为该品种的第2家过评企业。另外3家的新4类宝山申请已获受理或在审评审批中。
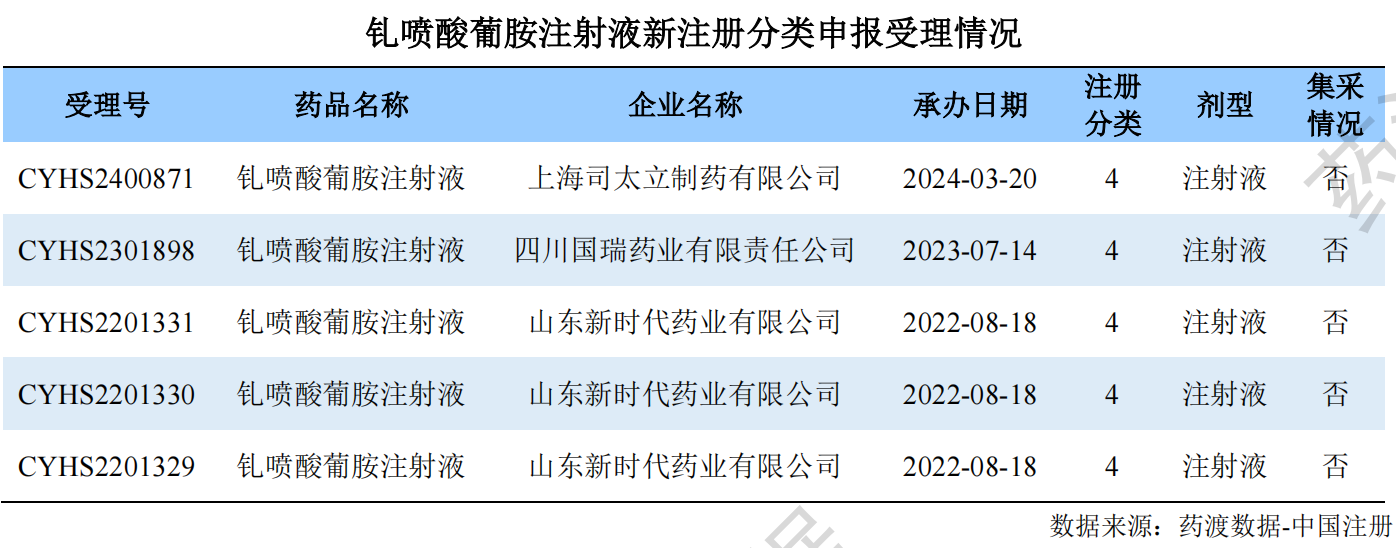
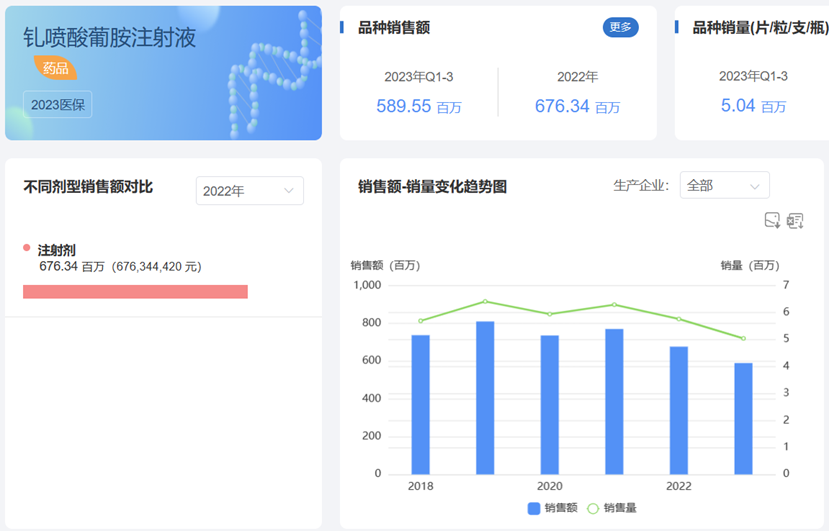
钆喷酸葡胺注射液具有适应症广泛、成像品质高的优点,临床使用效果反馈其增强效果优良,副反应较少,因此临床应用十分广泛。药渡数据-中国销量库统计数据显示,钆喷酸葡胺注射液近年来销售情况稳定,2022年度销售额超过6.76亿元。经谈判后进入2023国家医保乙类目录后,2023年前三季度销售额已经接近6亿元,全年销售超越2022已成定局。此外,药渡数据-中国销量库详细调研信息显示,原研企业拜耳的市场份额逐年减少,国内企业逐步发力,占据市场主流。目前市场前三名依次为:北京北陆制药、广州康臣药业和拜耳。
此次广州康臣药业通过一致性评价审评,势必将进一步提升产品竞争力,未来是否会超越“首家“过评企业,药渡将持续关注。
05
仿制药品种批准临床情况
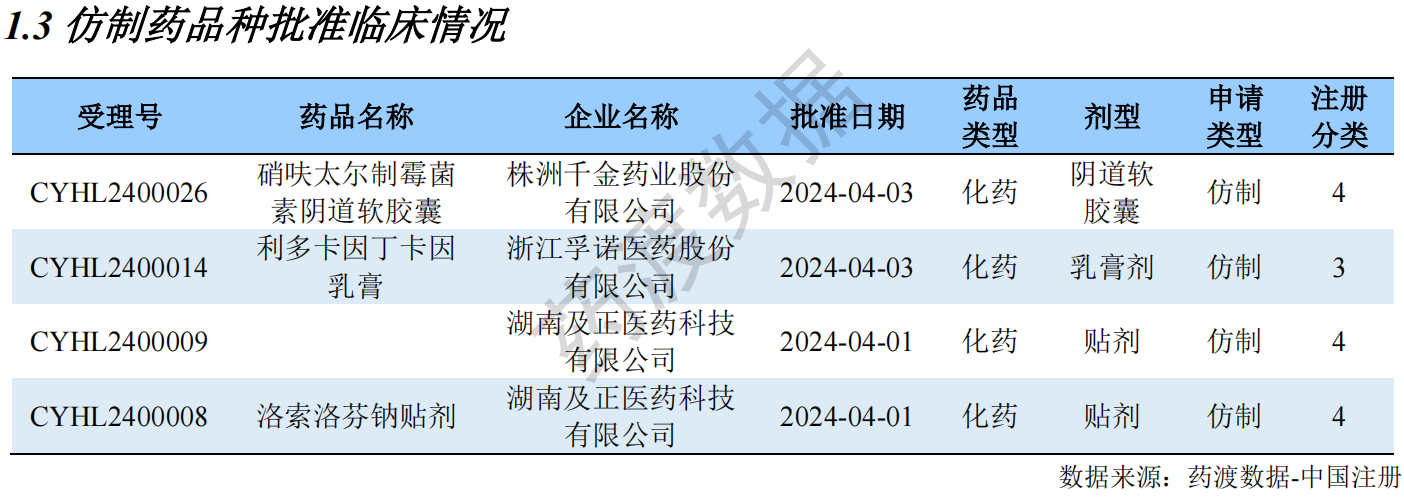
Part 2
国内仿制药研发批准动态
01
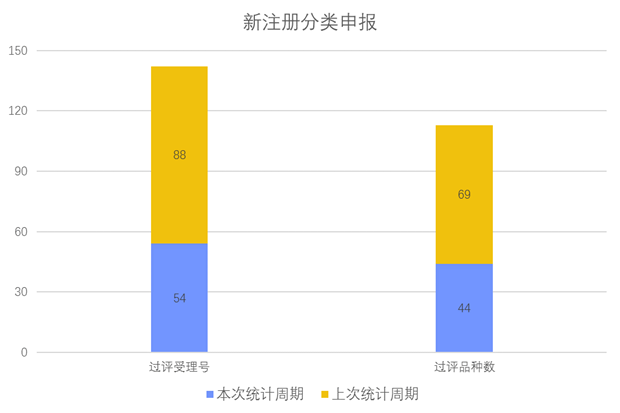
新注册分类品种申报上市情况
根据药渡数据调研,本次统计周期(2024.03.30-04.05)新注册分类数据新增54个新报受理号,涉及44个品种,包括10个注射剂、18个片剂、2个胶囊剂、4个滴眼剂、3个溶液剂、1个颗粒剂、1个乳剂、1个气雾剂、1个混悬剂、1个散剂、1个搽剂、1个滴剂。与上次统计周期相比,本次减少25个新注册分类申报品种。
新注册分类品种申报受理情况(部分)
02
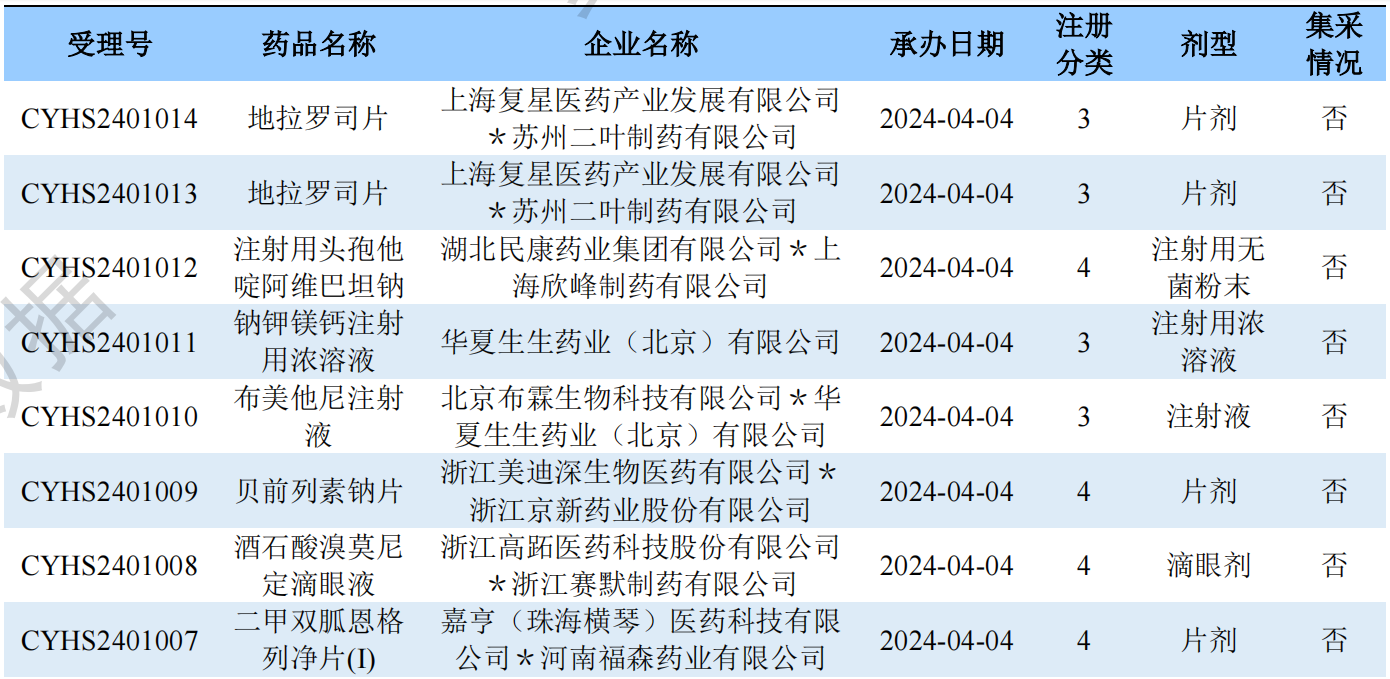
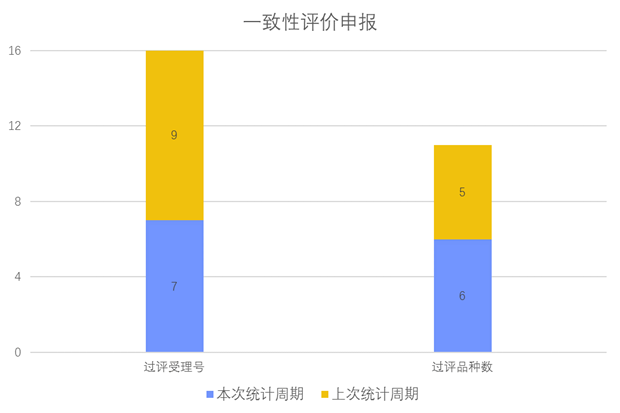
一致性评价品种申报上市情况
根据药渡数据调研,本次统计周期(2024.03.30-04.05)一致性评价数据新增7个新报受理号,涉及6个品种,包括1个胶囊剂,2个片剂,3个注射剂。与上次统计周期相比,本次增加1个一致性评价申报品种。
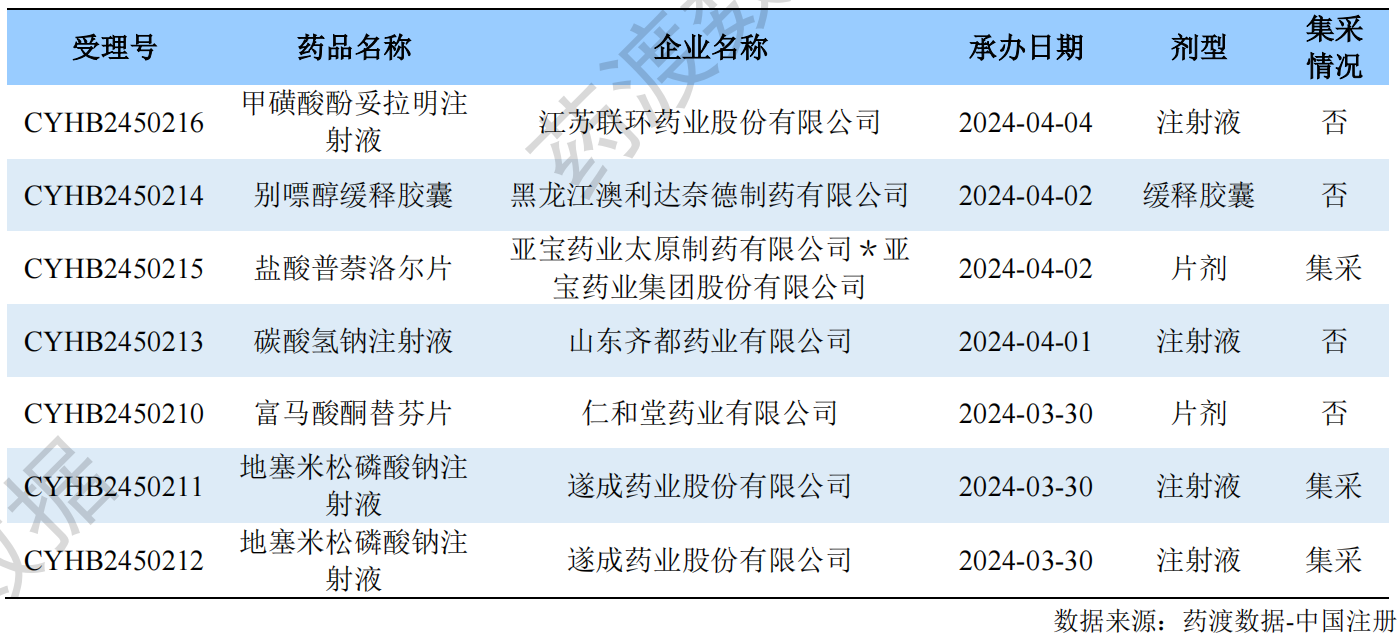
一致性评价申报受理情况
03
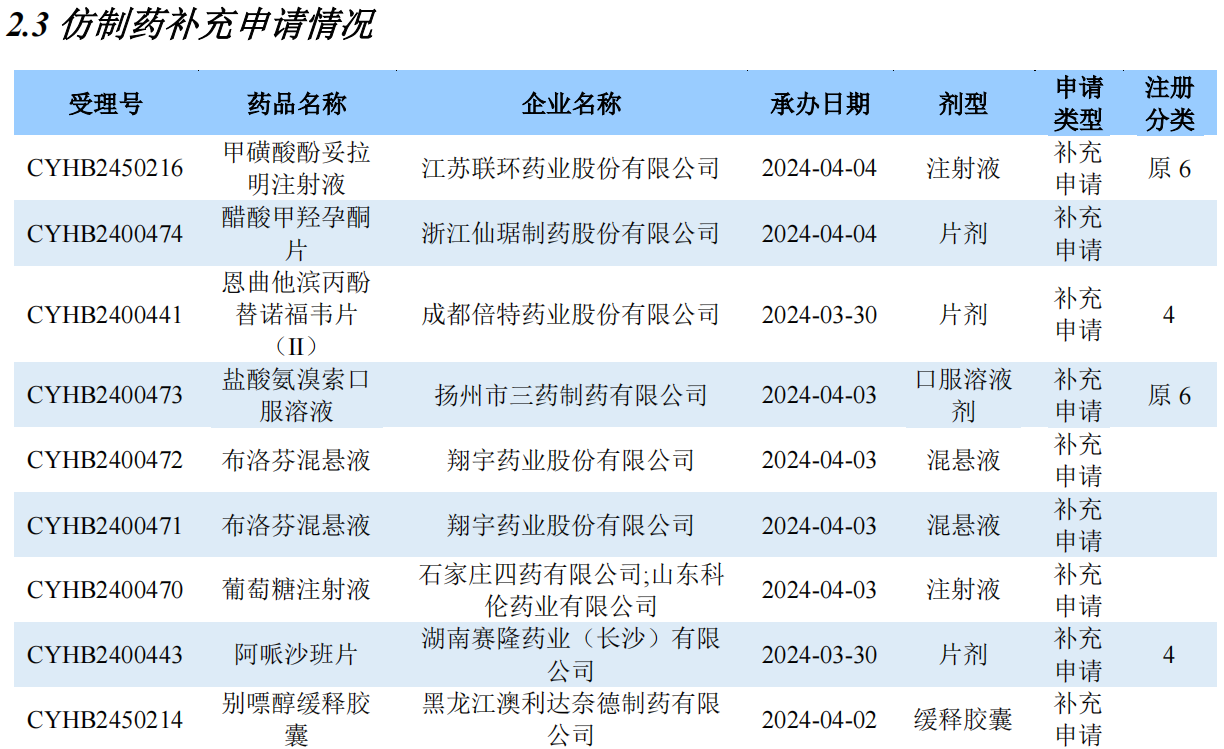
仿制药补充申请情况
04
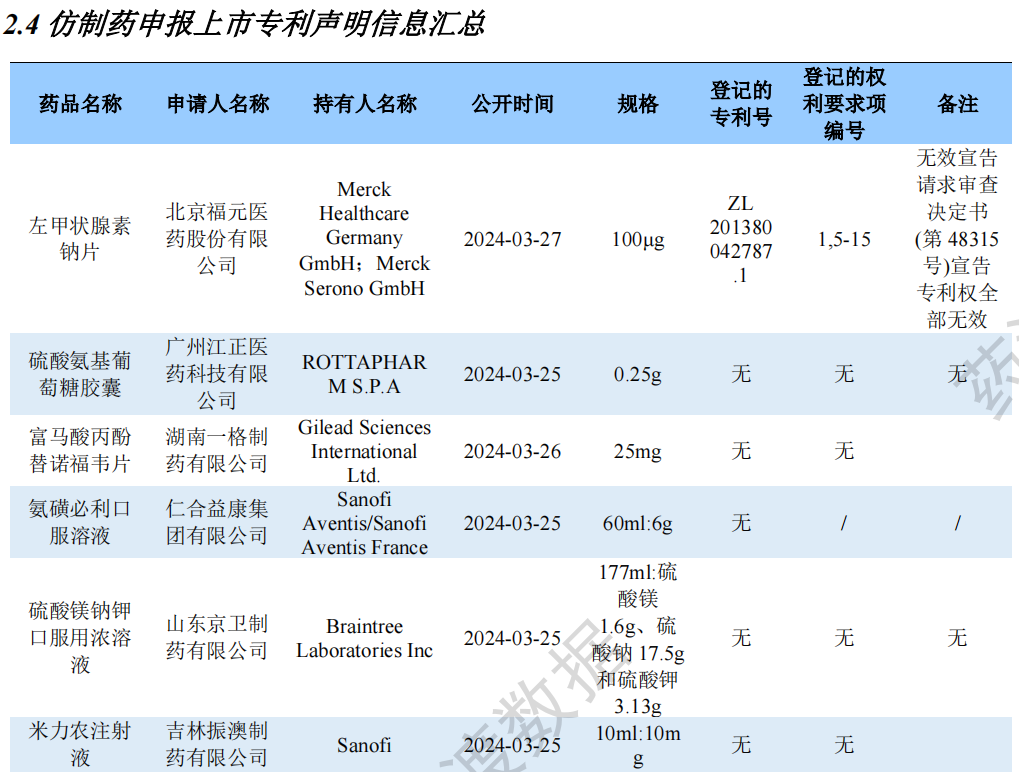
仿制药申报上市专利声明信息汇总
Part 3
国内仿制药研发领域热点聚焦
01
国内仿制药研发领域政策法规相关动态
国家药监局关于修订替硝唑注射剂说明书的公告(2024年第31号)
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药监局决定对替硝唑注射剂(包括替硝唑氯化钠注射液、替硝唑葡萄糖注射液、注射用替硝唑)说明书内容进行统一修订。现将有关事项公告如下:
一、所有上述药品的上市许可持有人均应当依据《药品注册管理办法》等有关规定,按照附件要求修订说明书,于2024年6月21日前报省级药品监督管理部门备案。
修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。在备案之日起生产的药品,不得继续使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换。
二、药品上市许可持有人应当对新增不良反应发生机制开展深入研究,采取有效措施做好药品使用和安全性问题的宣传培训,指导医师、药师合理用药。
三、临床医师、药师应当仔细阅读上述药品说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的获益/风险分析。
四、患者用药前应当仔细阅读药品说明书,使用处方药的,应当严格遵医嘱用药。
五、省级药品监督管理部门应当督促行政区域内上述药品的上市许可持有人按要求做好相应说明书修订和标签、说明书更换工作,对违法违规行为依法严厉查处。特此公告。
02
国内仿制药研发领域热点新闻
普利制药:关于注射用达托霉素获得德国联邦药物与医疗器械所(BfArM)上市许可的公告
2024 年4月3日,海南普利制药股份有限公司发布公告称,公司于近日收到德国联邦药物和医疗器械管理局(以下简称“BfArM”)签发的注射用达托霉素上市许可,现将相关情况公告如下:
一、药品基本情况
(一)药品名称:注射用达托霉素
(二)适应症:成人和儿童患者(1至 17 岁)的复杂性皮肤和皮肤组织感染;成人患者由金黄色葡萄球菌引起的右侧感染性心内膜炎;成人及儿童患者(1至 17 岁)的金黄色葡萄球菌血流感染(菌血症)。
(三)剂型:注射剂
(四)规格:350 mg;500 mg
(五)生产企业:海南普利制药股份有限公司
二、药品的其他相关情况
达托霉素是由 Lilly(礼来)公司最初研究,Cubist 制药公司开发的环脂肽类抗生素,2003年 9 月 12 号,美国食品药品监督管理局经过快速审理程序批准注射用达托霉素制剂,商品名为 CUBICIN,临床用于治疗复杂性皮肤及皮肤组织感染与金黄色葡萄球菌引起的菌血症,目前注射用达托霉素已在全球广泛上市销售。
普利制药的注射用达托霉素成功研发后,已相继提交了美国、荷兰、中国、本公司及董事会全体成员保证信息披露的内容真实、准确、完整,没有虚假记载、误导性陈述或重大遗漏。英国、澳大利亚和德国等多个国家和地区的仿制药上市申请,属于共线生产品种。本品于 2022 年 8 月获得美国食品药品监督管理局的批准,2022 年 11 月获得荷兰药物评价委员会的批准,2022 年 12 月获得国家药品监督管理局的批准,2023年 1 月获得澳大利亚药物管理局的批准,2023 年 7 月获得英国药品和健康产品管理局的批准。
近日,公司收到德国联邦药物与医疗器械管理局对本品的上市许可,这标志着普利制药具备在德国销售注射用达托霉素的资格,将对公司拓展德国市场带来积极影响。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57