7月24日,CDE官方显示,默沙东提交注射用MK-1022的临床试验申请获得受理。

MK-1022(第一三共研发代号HER3-DXd,Patritumab deruxtecan)是一款采用第一三共技术设计的潜在first-in-class靶向HER3的ADC,由全人源化抗HER3 IgG1单克隆抗体通过可裂解四肽连接子与拓扑异构酶I抑制剂有效载荷(一种依喜替康衍生物,DXd)连接组成。
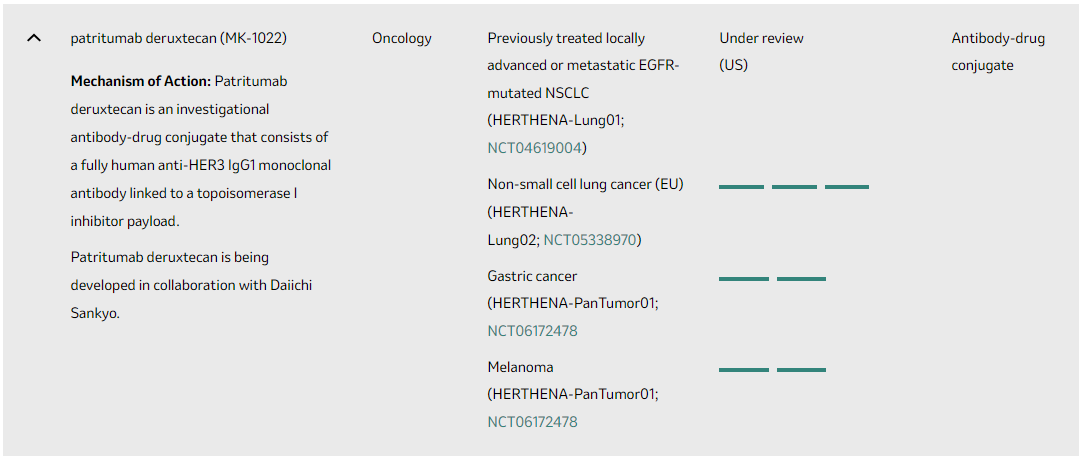
2023年12月22日,第一三共与默沙东联合宣布,美国食品药品监督管理局(FDA)已经对Patritumab deruxtecan的生物制品许可申请(BLA)进行了快速通道审查,该药物旨在为那些已经尝试过至少两种不同全身性治疗方案但病情仍处于局部晚期或转移性阶段的EGFR基因突变非小细胞肺癌(NSCLC)患者提供新的治疗选择。
该药物的最终审批日期被定在了2024年6月26日。值得注意的是,这一优先审查是基于FDA在2021年12月对该药物授予的“突破性疗法”认定。尽管在2023年6月26日,由于生产合作伙伴的问题,Patritumab deruxtecan的审批进程遭遇了暂时的延误,但根据现有的临床数据,该药物的疗效和安全性均得到了充分的验证。
BLA基于HERTHENA-Lung01研究结果:HER3-DXd对225例既往接受EGFR TKI和含铂化疗后出现病情进展的EGFR突变局部晚期或转移性NSCLC患者产生持久且具有临床意义的疗效,客观缓解率(ORR)为29.8%(95% CI:23.9~36.2),其中包含1例完全缓解(CR),66例部分缓解(PR)。此外,中位缓解持续时间(DOR)为 6.4 个月(95% CI,4.9-7.8),中位无进展生存期(PFS)为 5.5 个月(95% CI,5.1-5.9)。
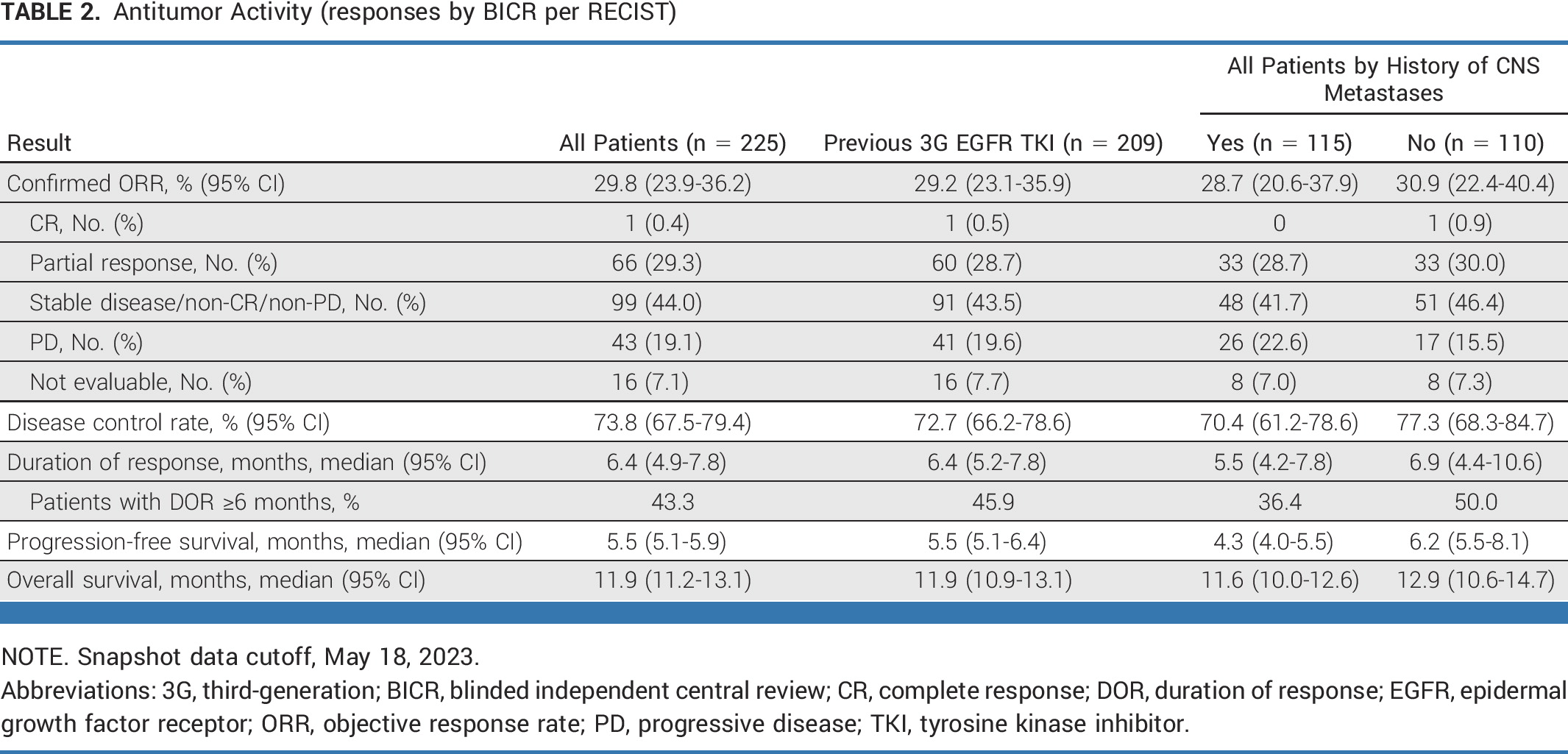
抗肿瘤活性
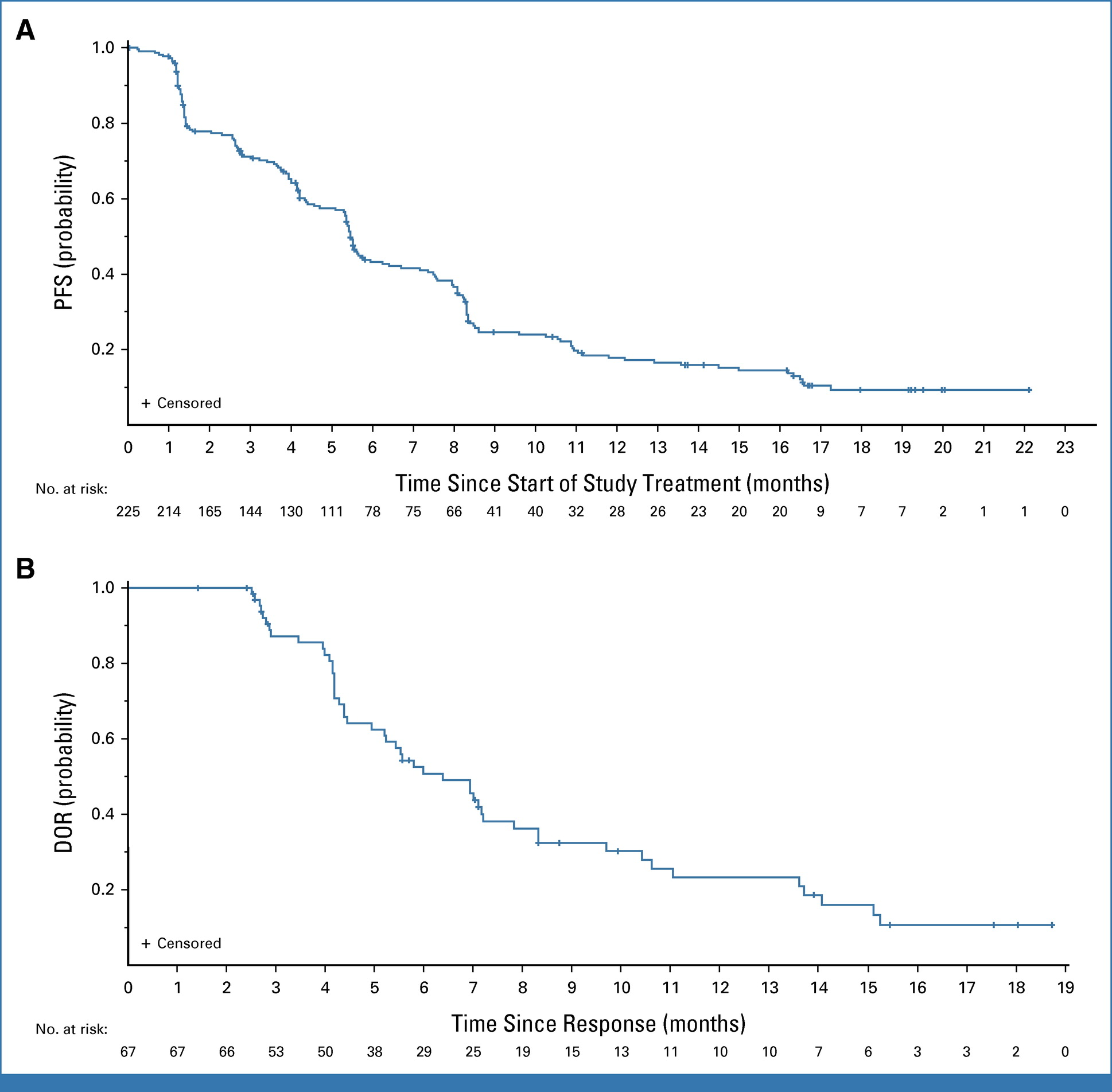
(A)PFS 和(B)DOR 的 Kaplan-Meier 图
安全性方面,因治疗中出现的不良事件(TEAE)导致终止治疗的患者比例较低(7.1%)。3级或3级以上的TEAE发生率为64.9%。
同时,Patritumab Deruxtecan还正在开展与铂类化疗在EGFR TKI治疗失败后的转移性或局部晚期EGFRm NSCLC中的疗效研究(NCT05338970)和局部晚期或转移性实体肿瘤患者中 HER3-DXd 的研究(胃癌和黑色素瘤,NCT06172478)。
资料来源:
1.CDE官网
2.默沙东官网



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57