近日,复星凯特益基利仑赛注射液的上市申请(相关受理号为CXSS2000006)进入行政审批阶段,这意味着国内首 款CAR-T产品即将出线。值得一提的是,该产品从上市申请获受理到现在不满一年时间。
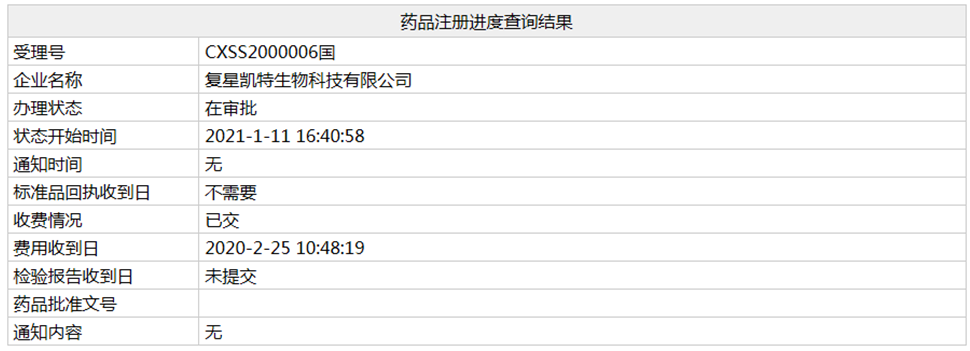
益基利仑赛(代号FKC876)是复星凯特从美国Kite Pharma引进Yescarta® (Axicabtagene Ciloleucel)技术、并获授权在中国进行本地化生产的靶向CD19自体CAR-T细胞治疗产品。Yescarta最早于2017年10月被FDA批准用于治疗复发难治性大B细胞淋巴瘤成人患者,包括弥漫性大B细胞淋巴瘤(DLBCL)非特指型、原发性纵隔B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的DLBCL,成为FDA批准的首 款针对特定非霍奇金淋巴瘤的CAR-T细胞药物。2018年9月,该药在欧盟获得营销授权许可,用于治疗经两次或以上系统性治疗的复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)和原发性纵隔大B细胞淋巴瘤(PMBCL)的成年患者。
Yescarta的获批是基于注册研究ZUMA-1的积极数据。该研究中共计101例患者接受了Yescarta单次输注,其中72%的患者表现出缓解,51%的患者未检测到癌症残留。中位随访7.9个月的数据显示,在已实现完全缓解的患者中,估计的缓解持续时间(DoR)尚未达到。
此外,该研究1年随访结果显示:最 佳总缓解率为82%,完全缓解率达到了54%;2年随访结果显示:中位随访27.1个月,仍有39%的受试者持续缓解,其中37%的受试者持续完全缓解。3年随访结果显示:中位随访时间39.1月,总生存率为47%,中位生存时间达到25.8月。
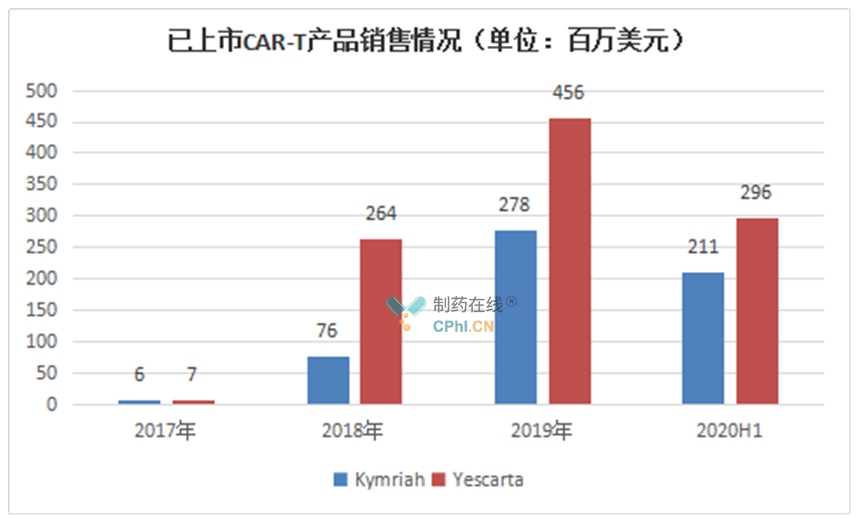
自上市后,Yescarta销售额逐年攀升,2019年销售额达456百万美元,成为销售额最高的一款CAR-T产品。
在国内,Yescarta于2018年9月被批准临床,2020年2月报产,申报的适应症为:治疗二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者。2020年3月,该上市申请被纳入优先审评程序。该药在国内迅速报产是基于在我国开展的一项单臂、开放性、多中心桥接临床试验(FKC876-2018-001)。
期待Yescarta可以早日在国内正式获批,据悉该药在美国市场的定价为37.3万美元,担心会因为治疗成本太高而难以惠及国内广大患者。
关于CAR-T疗法
CAR-T疗法是一种通过使用修复的免疫细胞攻击并摧毁恶性肿瘤的新型细胞疗法,是近年来全球肿瘤治疗研究的热点之一。据Coherent Market Insights分析,预计到2028年,CAR-T疗法全球市场规模将达85亿美元。
目前,全球已经批准3款CAR-T疗法,其中Kite Pharma占据两席。这三款CAR-T疗法作用靶点相同,适应症存在差异,详见下表。其中Tecartus(KTE-X19)是吉利德/Kite采用新生产工艺开发的CD19 CAR-T疗法,与Yescarta具有相同的CAR结构,但是在生产制备过程中,KT-X19 筛选掉了CD19+肿瘤细胞,以减少CAR-T细胞的过早激活和耗尽,提高生产成功率。
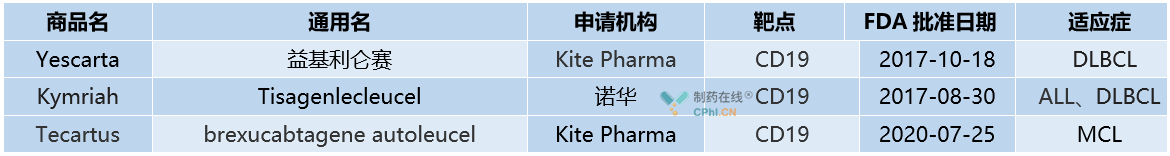
诺华的Kymriah上市最早,但是据公司财报其销售情况却逊于Kite Pharma的Yescarta,据披露,很大一部分是因为Kymriah早期产能不足。此外,Kymriah有时无法在需要时可靠地递送药物,达到FDA为诺华一直努力维持的商业规格设定的更高标准。Tecartus获批较晚,具体销售情况未知。
此外,还有多款CAR-T疗法已经递交上市申请,如BMS/bluebird bio的idecabtagene vicleucel(ide-cel,又名bb2121)、BMS的lisocabtagene maraleucel(liso-cel,JCAR017)、药明巨诺的瑞基奥仑赛(Relma-cel,JCAR029)以及杨森/传奇生物的西达基奥仑赛(cilta-cel)。其中,ide-cel是BMS和bluebird bio联合开发的一款靶向BCMA的CAR-T疗法,于2020年3月首次向FDA递交治疗至少经过3种治疗方案的多发性骨髓瘤的上市申请,但惨遭FDA拒批,随后又再次递交上市申请。liso-cel是Juno(2018年被新基收购,2019年新基又被BMS收购)研发的一种针对CD19抗原、以4-1BB为共刺激区的CAR-T细胞疗法,其中CD4+和CD8+CAR-T细胞具有精确的1:1比例,被开发用于治疗先前接受过至少两种疗法的复发或难治性大B细胞淋巴瘤(R/R LBCL)成人患者。瑞基奥仑赛是在药明巨诺在JCAR017的基础上自主开发一款针对复发或难治B细胞淋巴瘤的三线治疗的抗CD19 CAR-T细胞疗法,2020年6月其三线治疗弥漫性DLBCL的上市申请被CDE受理。西达基奥仑赛是南京传奇自主研发的靶向B细胞成熟抗原(BCMA)的定向嵌合抗原受体T細胞(CAR-T)疗法。2017年12月,南京传奇授予杨森在全球共同开发和推广cilta-cel权利。2020年12月,杨森与南京宣布开始向FDA滚动提交该药治疗成人复发和/或难治性多发性骨髓瘤(MM)的上市申请。
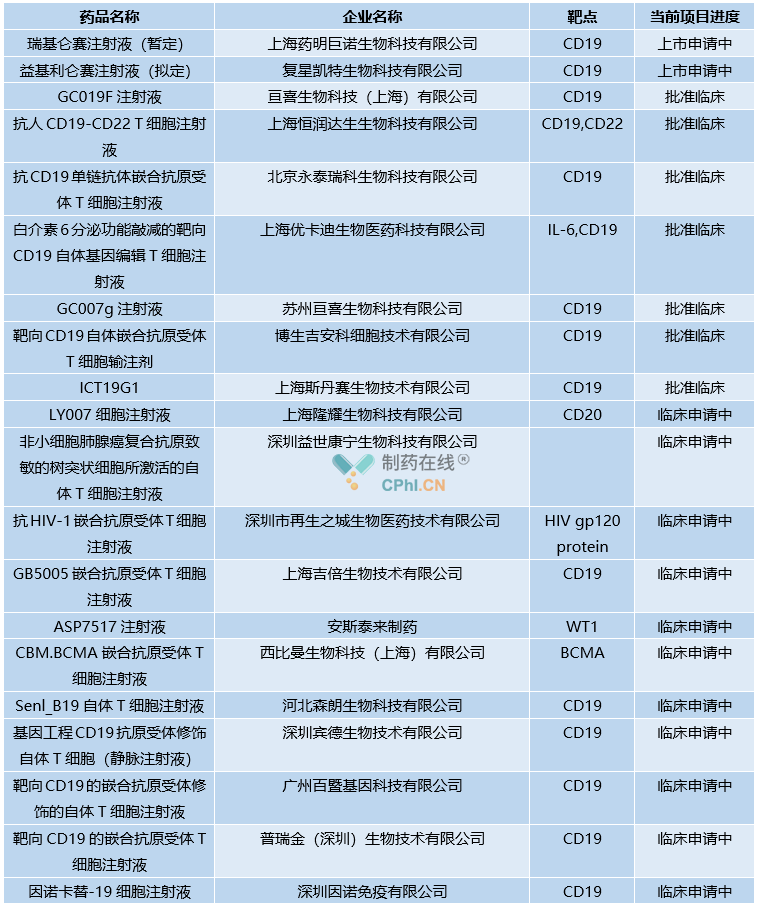
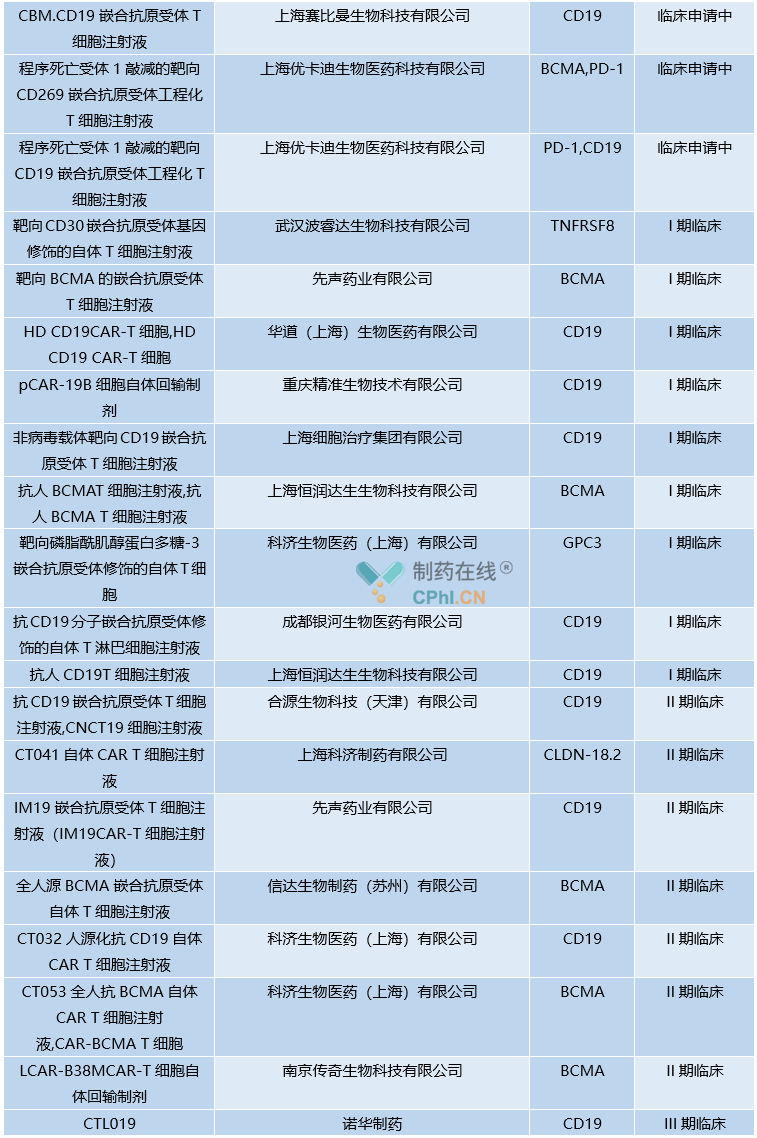
但在国内,还未有任何一款CAR-T疗法正式获批。除了益基利仑赛,药明巨诺的瑞基奥仑塞也已递交上市申请。此外,国内还有多款在研CAR-T疗法,大多已经批准临床或者处于临床试验阶段。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57