引子
2021年11月11日,俞敏洪在直播间谈到了新东方向多家农村学校捐献新课桌。俞敏洪称,新东方只是关闭了义务教育阶段的培训业务,新东方起家的国际业务和大学业务都还在持续发展中,同时还在积极带领团队开拓农业平台。或许不破不立,这次“双减”政策将会给新东方带来一个全新的世界。看到这里,笔者想到最近十多年,国家陆续出台了很多有关制药行业的政策。这些政策的出台,已经、正在、必将给制药行业带来一个全新的世界。
正文
一、国家发布的法律法规、部门规章和标准
2011年1月17日,由中华人民共和国卫生部发布,并于2011年3月1日开始实施的《药品生产质量管理规范(2010年修订)(卫生部令第79号)》;2011年5月4日,由中华人民共和国卫生部发布,并于2011年7月1日开始实施的《药品不良反应报告和监测管理办法(卫生部令第81号)》;2019年8月26日第十三届全国人民代表大会常务委员会第十二次会议第二次修订)《中华人民共和国药品管理法》;2020年1月22日,由国家市场监督管理总局发布,并于2020年7月1日开始实施的《药品注册管理办法(国家市场监督管理总局令第27号)》;2020年1月22日,由国家市场监督管理总局发布,并于2020年7月1日开始实施的《药品生产监督管理办法(国家市场监督管理总局令第28号)》;由国家药典委员会发布,并于2020年12月30日开始实施的《中华人民共和国药典(2020年版)》;2021年1月12日,由国家药品监督管理局发布,并于2021年1月12日开始实施的《药品上市后变更管理办法(试行)》;2021年5月24日,由国家药品监督管理局发布,并于2021年5月24日开始实施的《药品检查管理办法(试行)》。
自从2011年开始实施的《药品生产质量管理规范(2010年修订)以来,制药行业的法律法规、规章制度、指导原则等越来越多,对制药企业的要求越来越细,越来越具体。这些要求不断将那些不合规、产品质量不过关的企业淘汰出局,让合法合规的制药企业越来越健康,并提供安全、有效的药品。

二、2021年上半年药品违法案件查处情况
2021年上半年,全国共查处药品违法案件20167件,案件货值金额1.94亿元,罚款金额4亿元,没收违法所得8160.91万元[1]。从案件来源看,药品违法案件主要来源于日常监管和专项检查,其中第一季度5798件、第二季度10097件。此外,还有监督抽检、投诉举报、其他部门通报等来源。药品日常监管和专项检查的基础,就是《药品生产质量管理规范(2010年修订)(卫生部令第79号)》、《药品注册管理办法(国家市场监督管理总局令第27号)》、《药品生产监督管理办法(国家市场监督管理总局令第28号)》、《中华人民共和国药典(2020年版)》、《药品上市后变更管理办法(试行)》和《药品检查管理办法(试行)》等。药品违法以及被处罚的依据是《中华人民共和国药品管理法》。
三、停止生产、销售和使用的药品
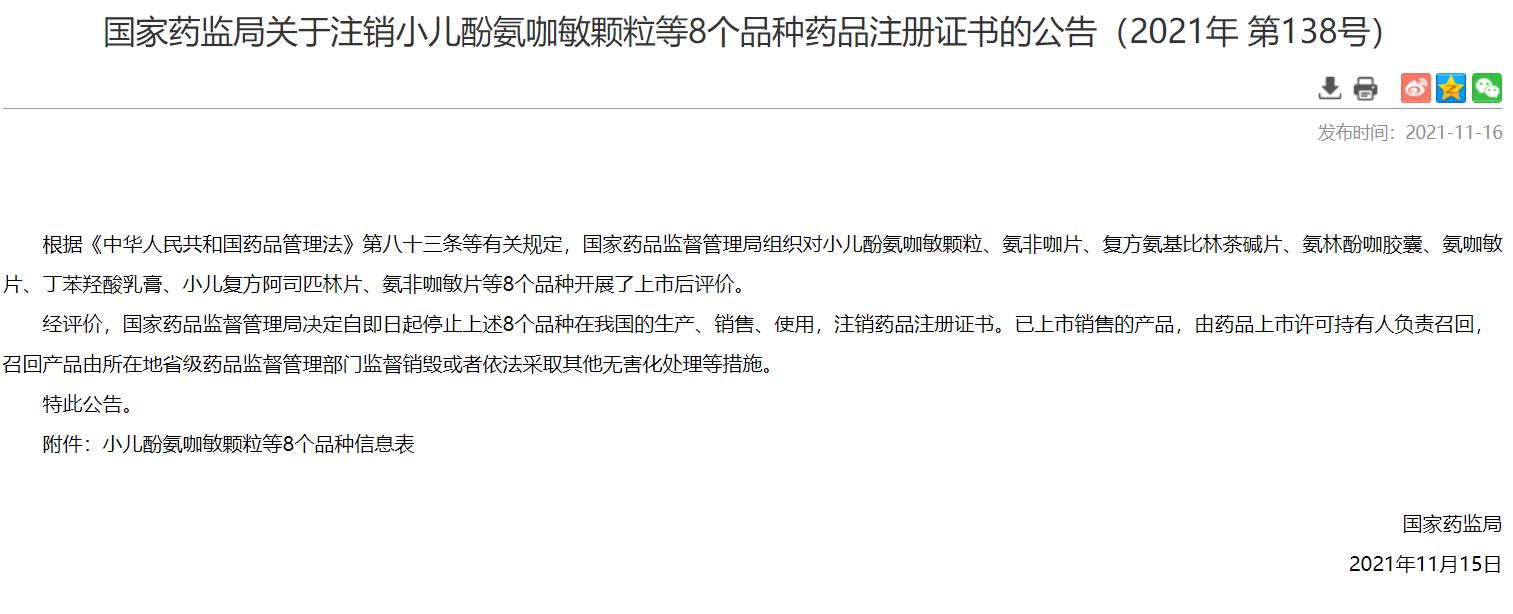
2021年1月8日,国家药品监督管理局在其官网通过《国家药监局关于注销酚酞片和酚酞含片药品注册证书的公告(2021年 第6号)》,决定从2021年1月8日起,停止酚酞片和酚酞含片在我国的生产、销售和使用,注销药品注册证书(药品批准文号)。已上市销售的酚酞片和酚酞含片由生产企业负责召回,召回产品由企业所在地药品监督管理部门监督销毁。2021年11月15日,国家药品监督管理局在其官网通过《国家药监局关于注销小儿酚氨咖敏颗粒等8个品种药品注册证书的公告(2021年 第138号)》 公告称,经开展上市后评价,小儿酚氨咖敏颗粒、氨非咖片、复方氨基比林茶碱片、氨林酚咖胶囊、氨咖敏片、丁苯羟酸乳膏、小儿复方阿司匹林片、氨非咖敏片8个品种,从2021年11月15日停止上述8个品种在我国的生产、销售、使用,注销药品注册证书。已上市销售的产品,由药品上市许可持有人负责召回,召回产品由所在地省级药品监督管理部门监督销毁或者依法采取其他无害化处理等措施。
通过对已上市药品进行评价,让那些已不满足要求的药品彻底退出市场,就是为了新的、更安全的药品进入市场,提供给患者。
四、2021年上半年药品审批情况
今年上半年,国家药监局共批准境内生产药品临床试验申请641件,其中中药天然药物17件、化学药品416件、生物制品208件;国家药监局共批准636件新上市药品申报,包括1类化学药品23件、2类化学药品31件、3类中药天然药物3件、3类化学药品93件、4类化学药品421件、5类化学药品65件;国家药监局共批准创新药上市品种21个,包括16个化学药品和5个生物制品;国家药监局还批准创新药临床试验申请649件,包括中药天然药物13件、化学药品455件、生物制品181件;共有21件仿制药临床试验申请获批,全部为化学药品;共有573件化学仿制药上市申请获批。
通过审批,让新药不断进行市场,来填补市场空白,并加快过时产品的淘汰,为患者提供更安全和有效的药品。
五、药品管理细化
2021年,国家药品监督管理局开辟了儿童用药专栏,专门用于儿童用药的监管。儿童用药,需要根据其身体以及生理特点制定满足其群体需要的药品。这就需要建立一系列相关的法律法规和标准,并由相关机构和制药企业一起,生产出可满足儿童群体需要的要求,并保证安全、有效和可及。

总结
2020年12月30日,开始实施的《中华人民共和国药典(2020年版)》就是制药行业最严谨的标准之一;2019年修订的《中华人民共和国药品管理法》就是最严格的监管依据之一;2021年上半年,全国共查处药品违法案件20167件,案件货值金额1.94亿元,罚款金额4亿元,没收违法所得8160.91万元,就是最严厉的处罚之一。 制药行业为了应对政策的变化,特别是合规性,不少企业开始设置“法规事务部门”或者“法规事务负责人”岗位,并制定、实施、评价、维护和改进公司合规管理体系[2],确保制药企业合法、合规生产经营。
国家根据对上市产品进行风险评估,停止生产、销售和使用的药品。国家也通过审批,让不少新的药品进入市场。同时,国家通过相关政策,保证短缺药品生产供应,都是为了用药安全、有效和可及。
总之,国家和政府,通过建立和完善相关的标准;建立和完善相关的法律法规和部门规章、指导原则;建立和完善监管制度、机构和团队;是为了用最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责,确保人民群众用药安全、有效和可及。
参考资料:
[1] 一、二季度药监统计报告数据分析,国家药品监督管理局信息中心&中国食品药品监管数据中心
[2]合规管理体系指南 GB/T 35770-2017
作者简介:老陈,质量管理专家,从事食品与制药行业质量管理和质量控制相关工作近二十年,历任QA主管、质量部长、质量经理和生产厂长等职。在国内著名的跨国明胶企业负责质量和食品安全管理体系管理工作。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57