FDA的加速批准流程为无数患者尽早得到重大突破药物的治疗带来福音,却同时也带来了无效的疗法,造成了支付方的压力。成也萧何,败也萧何。在巨大的压力下,加速批准流程的未来何去何从?
01 什么是加速批准?
加速批准(Accelerated Approval)是FDA用以加速治疗严重疾病、并且与现有药物相比具备显著优势的药物上市,给病人尽早带来治疗的一种手段。在加速批准中,药物是否通过审批通常是以替代终点做为依据。
通过加速批准后,制药公司仍需要进行临床研究以确认预期的临床益处。如果验证性试验表明该药物确实提供了临床益处,FDA会给与该药物正式的批准。如果验证性试验未显示该药物提供临床益处,FDA会将该药物从市场上移除。
加速批准流程的益处是显而易见的,它大幅度地缩短了很多肿瘤治疗药物上市的时间。对于很多肿瘤患者来说,能够早一天接受治疗,意味着多一份希望。但同时,其缺点也显而易见,替代终点预计最终临床效果有偏差。一些药物上市之后的临床验证实验进展缓慢,或者被证明无效,很多情况下FDA对药品撤回决定反应迟缓,最终造成了患者接受无效治疗,而支付方也支付了数额巨大的无效疗法。
02 近期哪些加速批准药物被撤回?
肿瘤类药物一直是申请和获得FDA加速批准的主要药物。FDA自1992年加速批准流程启动以来,共有167个肿瘤适应症获批,其中只有15个(8.9%)最终被撤回,其中包括14个公司自愿撤回和一个被FDA撤回。尽管如此,FDA的这一审批流程最近遭到了很多尖锐的批评。2021年底的一个研究表明,联邦老人医疗保险(Medicare)在2017至2019年之间,为四种最终被撤回的肿瘤药物花费了超过2.24亿美元。
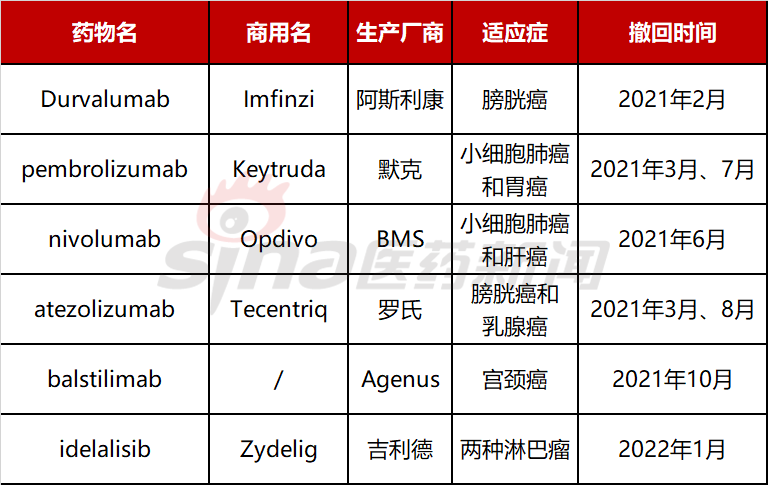
2021年曾经发生了一系列的PD-(L)1类药物从已被FDA快速批准的适应症撤出事件。虽然这些撤销都是厂家自愿的,但都是与FDA沟通后做出的决定。撤出的原因也都是因为药物的验证性试验数据不佳。一些曾被寄予高期望的PD-(L)1类药物在一些适应症的头对头试验中,最终临床结果反而低于或者与标准疗法相持平。
2021年和2022年部分被撤回药物名单
03 近期FDA快速批准的药物有哪些值得期待?
2021年经过FDA快速批准通道获得审批的药物达到了39个,其中包括肿瘤学、免疫学、心血管等多个领域的药物。这些药物中,引人注目的有渤健治疗阿尔茨海默病的药物Aduhelm (2021年6月获批),与安进治疗局部晚期或转移性非小细胞肺癌的药物Lumakras (2021年5月获批)。
众所周知,Aduhelm从获批的那天起就充满了争议。FDA专家因不同意FDA批准其上市的决定而辞职,医院诊所拒绝渤健的Aduhelm的销售人员进入,CMS仅当患者参加了合格的临床试验时才能使用Medicare报销……种种的不尽人意使Aduhelm的2021年第三季度销售额只有区区的30万美元。尽管如此,渤健还是没有放弃Aduhelm。2021年12月中旬,渤健宣布与其开发合作伙伴卫材(Eisai)一起,计划于2022年3月向FDA提交临床四期试验的最终方案,并于2022年5月开始患者筛查。两家公司预计将招募1300多名早期阿尔茨海默病患者,可能在研究开始后的四年内完成。
Lumakras是安进生产的KRAS阻断类抗癌药物。KRAS这种基因在许多肺、结肠和胰 腺肿瘤中经常发生突变。很多研究针对它的努力一再失败,为这个难以捉摸的基因赢得了“不可成药”的恶名。Lumakras的批准是癌症研究领域的最新进展。在临床试验中,使用Lumakras治疗可使超过三分之一的以前接受过其他药物治疗的晚期肺癌患者的肿瘤缩小。反应持续中位时间为10个月,中位无进展生存期接近7个月。一项将Lumakras与化疗进行比较的临床试验,也就是FDA要求的验证性实验,最近完成了志愿者的招募工作。
04 FDA改革的方向是什么?
由于卫生界和医药界对FDA加速批准流程进行了多番质疑,HHS(United States Department of Health and Human Services)监察长办公室于2021年8月启动了对FDA加速批准流程的审查。可以想见,大幅度的改革势在必行。
FDA对加速批准流程的改革在很大程度上可能会借鉴欧盟、英国、瑞士和澳大利亚等国家监管机构的相似流程。改革的方向之一是可能会给验证性试验的完成加上一个期限,以此来确保各公司尽早完成试验,向FDA提交药物临床益处数据以完成最后的审批。FDA的数据表明,如果药物在进入加速批准流程时就已经开始验证性临床试验的话,其提交最终数据的时间将会显著缩短,中位数为3.1年。而没有开始验证性试验的药物提交这一数据的中位数时间为5.5年。
另一个改革的方向可能是药物获得进入加速批准流程的条件。在欧盟、瑞士、英国等国家,只有新的分子才有可能获得加速批准,而在美国,同一种分子的不同种适应症都可以被加速批准。临床试验的设计,比如是单臂还是双臂设计,预测临床益处的终点可依赖性是否高,都将是FDA在选择药物进入加速批准流程的考量。
参考:
1. Time limits on accelerated approvals? FDA's oncology chief Rick Pazdur eyes potential reforms via international approaches
2. Failed cancer immunotherapies cost Medicare hundreds of millions. How should FDA revamp accelerated approvals?
3. Accelerated Approval Program
4. Merck withdraws Keytruda from SCLC indication amid FDA crackdown
5. Bristol Myers withdraws Opdivo in liver cancer as fallout from FDA meeting continues
6. Gilead pulls 2 cancer accelerated approvals as changing lymphoma landscape disrupts confirmatory



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57