自2020年新冠肺炎病毒流行以来,全球疫情防控持续紧张,反复抬头。特别是随着奥密克戎的出现,加速变异传播,全球疫情大流行仍然看不到终结的迹象。
**作为抗击新冠最有力的武器,虽然国内及欧美等国家已达到较高接种率,但从全球来看,在**分配上依然不均衡。例如,非洲的**接种率仍徘徊在 11% 左右,距离世卫组织在今年年中实现 70% 的接种率目标还很远。
为确保**在全球范围内公平和公正地分配,世卫组织早在2020年就与全球**免疫联盟和流行病防范创新联盟一起建立了新冠肺炎**实施计划(COVAX)。
而得到WHO紧急使用清单(EUL)的授权,是向包括COVAX机制参与国在内的众多国家出口**的先决条件。
什么是EUL?
根据世界卫生组织官网介绍,EUL是世卫组织在突发公共卫生事件中为评估新卫生产品的适用性所形成的机制,目标是尽快提供药物、**和诊断工具。评估过程会对**第二阶段末期和第三阶段临床试验数据以及关于安全性、有效性、质量和风险管理计划的大量额外数据进行严格审查。
申请进入紧急用途列表过程中,**生产企业必须承诺继续生成数据,直至**得到完全许可和世卫组织预认证。世卫组织预认证程序将以滚动方式评估**试验和部署产生的更多临床数据,确保**达到必要的质量、安全性和有效性标准,从而扩大**供应。
查询WHO官网,一款新冠病毒**要获得世卫组织批准需要经过三个阶段:
EOI accepted:世卫组织受理
Pre-submission meeting held:专家会议评审
Dossier accepted for review:临床试验病例审核
WHO下属的免疫战略咨询专家组(SAGE),负责审查证据并就**相关的政策和剂量等提出建议。
鉴于不同种类的**之间,功效、效果和效益很难做简单的优劣对比,涉及对轻症、重症、需住院治疗的重症、储存要求、注射次数、常见和罕见副作用、成本等。因此,WHO评估**的主要标准包括有效率至少50%,以及生产制造达标。
对于**研发企业来说,进入紧急使用清单,意味着**的安全性和有效性得到了认可。获得WHO批准的**可由联合国机构购买并分发给需要的国家,没有获得WHO批准的**,只能由各个国家自行购买,而大多数国家没有购买能力。
10种新冠**获得WHO批准
根据WHO官网3月2日更新的新冠**紧急使用名单(Status of COVID-19 Vaccines within WHO EUL/PQ evaluation process),目前WHO共批准了10种新冠**的紧急使用,来自辉瑞、阿斯利康、强生、Moderna、Novavax、Bharat Biotech、北京生物、中国生物制药等企业。
以下为截至2022年3月2日世卫组织新冠病毒**批准进度:(双击可放大查看原图)
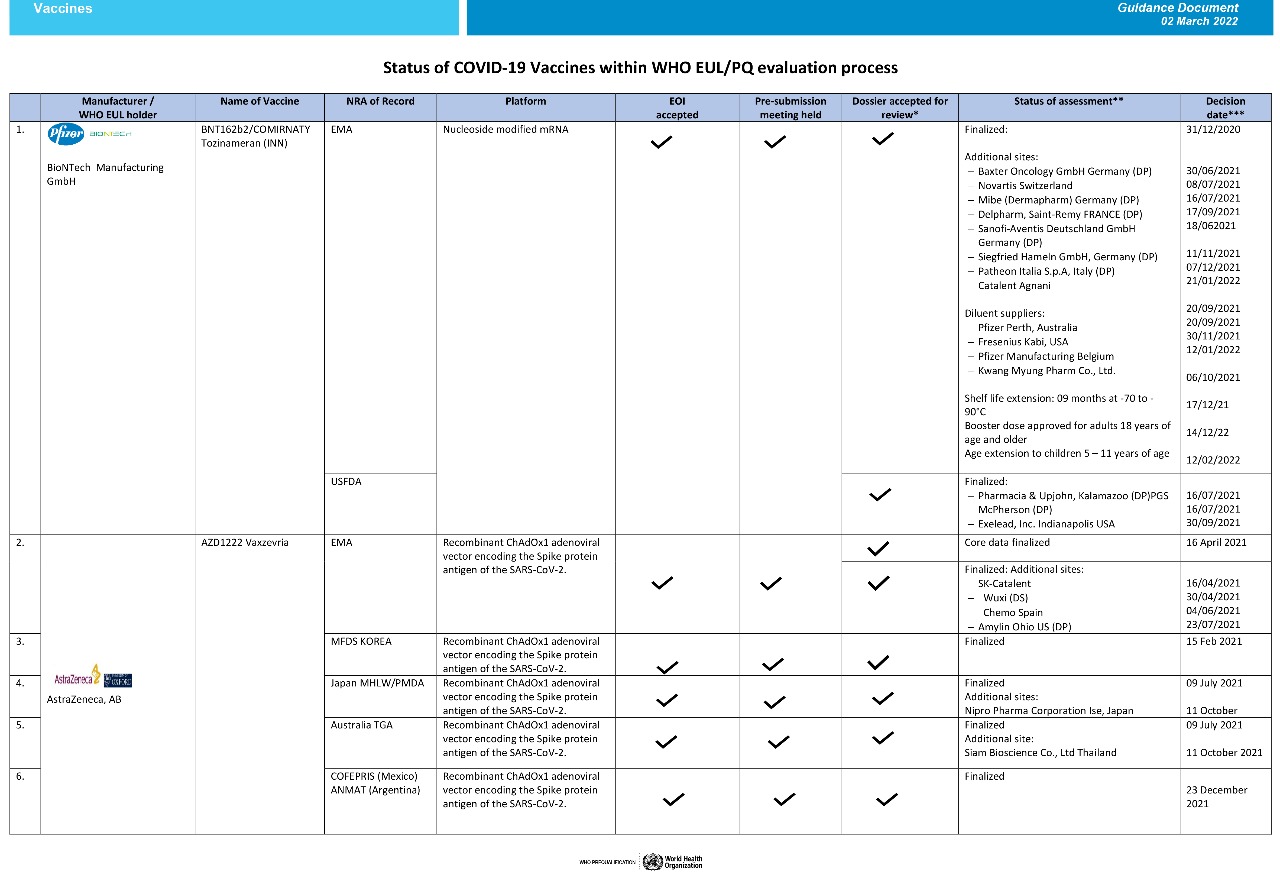
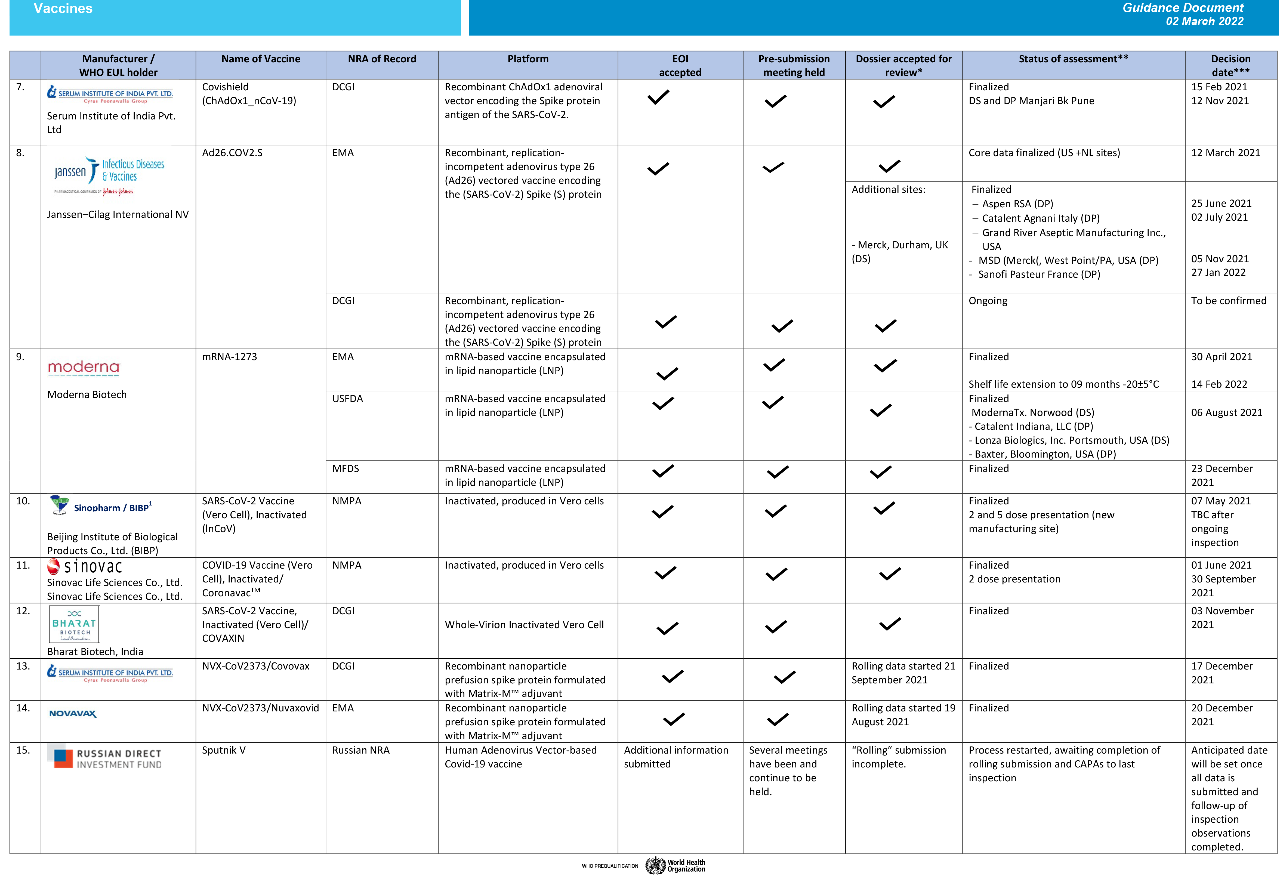
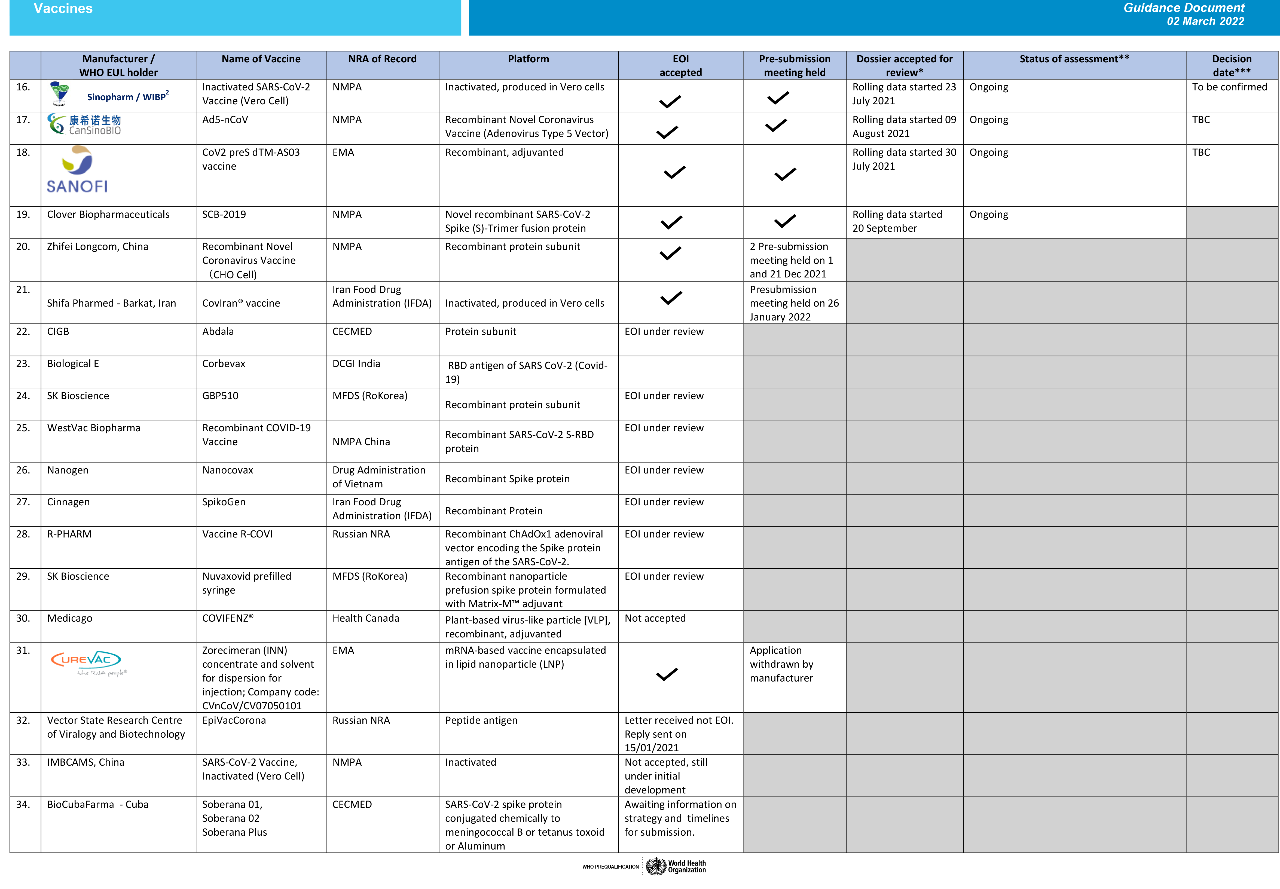

数据来源:WHO官网
辉瑞/BioNTech的mRNA**BNT162b2,是最早获得WHO批准的新冠**。
2020年11月18日,辉瑞公布了BNT162b2的三期临床结果,12月2日率先在英国获批紧急使用,随后12月11日、21日又先后获得美国食品药物管理局(FDA)与欧洲药品管理局(EMA)批准紧急使用,12月31日获得世卫组织批准紧急使用。进展可谓神速。
为何获批这么快?原因可能是辉瑞采取的是“Use abridged procedure relying on EMA”,即“使用欧洲药品管理局的便捷申请程序”。世卫组织有一份它在质量管控上信任的“严格监管机构”清单,当清单上的国家研制并批准一款**时,世卫组织可以开启便捷程序快速批准,不在清单上的国家则需要世卫组织从头开始进行全面评估。清单上包括美国、澳大利亚、加拿大、日本、和一些欧洲国家。
随后,阿斯利康的腺病毒载体**AZD1222、强生的重组蛋白**Ad26.COV2.S、以及Moderna的mRNA**mRNA-1273也先后基于便捷程序快速获得世卫组织批准。
此外,韩国SK Bio公司和印度血清研究所(SII)生产的阿斯利康**即Covishield也获得了WHO批准。
获得EUL认证的还有2款国产的新冠灭活**,分别来自中国生物北京生物制品研究所(Sinopharm/BIBP)和科兴生物(Sinovac)。
2021年,5月7日,世卫组织批准国药中生北生所新冠**列入“紧急使用清单”,这是全球第6款被WHO列入紧急使用清单的**。这也是有史以来第一次,非西方国家研制的传染病**,获得WHO紧急使用许可。随后,6月1号,科兴生物的Sinovac也获得了WHO批准。
值得注意的是国药中生武汉生物所(Sinopharm/WIBP)的新冠**虽然早已在国内投入使用,但是还没得到WHO紧急使用批准,相关评估仍在进行当中。
另外,清单上还有印度制造商Bharat生物公司的灭活**COVAXIN,和Novavax公司的两款Matrix-M佐剂重组蛋白**NVX-CoV2373/Nuvaxovid和NVX-CoV2373/Covovax。
6种国产新冠**还在审评中
根据WHO 3月2日更新的数据显示,除已获得批准的10种**外,还有20种**正在接受WHO紧急用途清单(EUL)和资格预审(PQ)评估。
其中有6种来自中国,申请企业为国药中生武汉生物、康希诺、智飞生物、三叶草生物、威克斯生物、医科院生物所。
其中,国药中生武汉生物(Sinopharm/WIBP)的新冠灭活**Inactivated SARS-CoV-2
Vaccine (Vero Cell)、康希诺的腺病毒载体新冠**Ad5-nCoV、以及三叶草生物的联合佐剂使用的三聚体重组蛋白新冠**SCB-2019已经完成了受理和专家会议评审程序,正在进行第三阶段临床试验病例审核。
智飞生物新冠**Recombinant Novel Coronavirus Vaccine (CHO Cell)仍处于世卫组织紧急使用清单预认证评价过程中的第二阶段——专家会议评审,已经在2021年12月1日、21日,提交了预申请。通过第二阶段后,还将进行第三阶段的审评。
成都威克斯生物的重组蛋白新冠**和中国医学科学院医学生物学研究所生产的新型冠状病毒灭活**(Vero细胞)还没完成第一阶段审核。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57