背景
集团计划将英国工厂生产的辅料在国内销售。委托我公司质量部将其相关信息在国家药品监督管理局药品审评中心进行登记。
正文
本文将本次登记过程,通过文字和图片格式记录下来,以飨读者。
一、 创建登记号
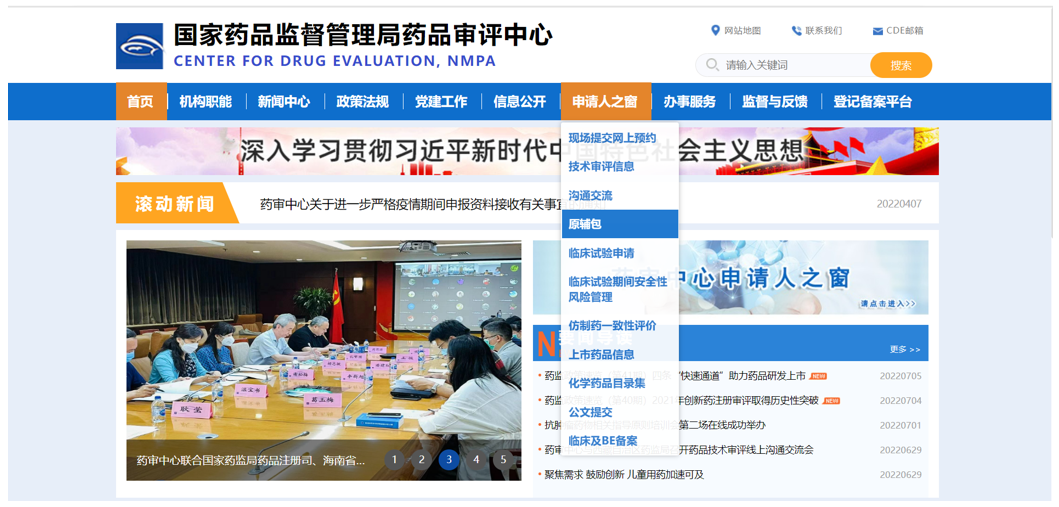
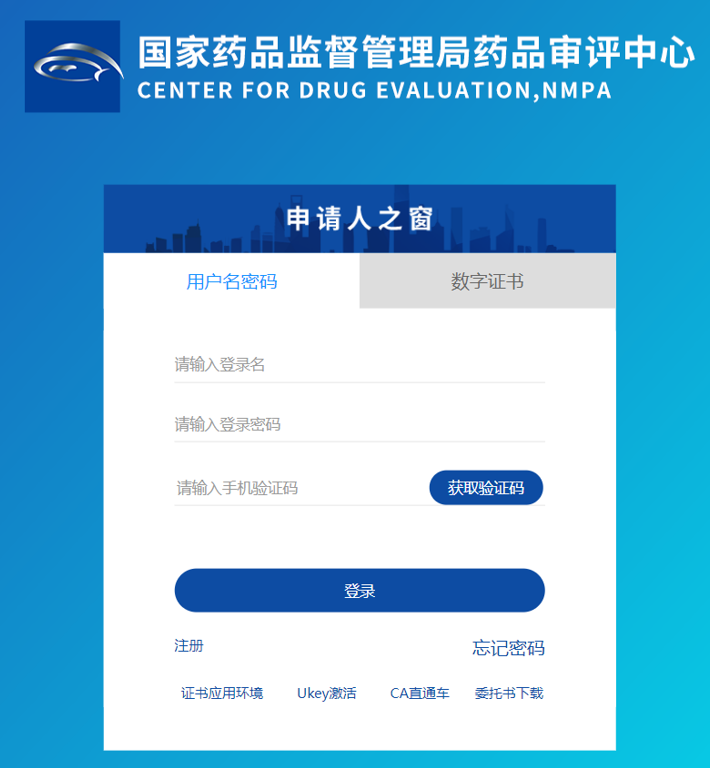
登录《国家药品监督管理局药品审评中心》https://www.cde.org.cn/,在首页上边找到一行找到"申请人之窗",下拉找到"原辅包"(见下图),点击后打开。在《申请人之窗》输入自己公司的登录名、登录密码和手机验证码,然后点击"登录"进行登录
如果新公司,还没有自己公司的账号,则在在《申请人之窗》下面,点击"注册"进行注册。注册后,进行登录。
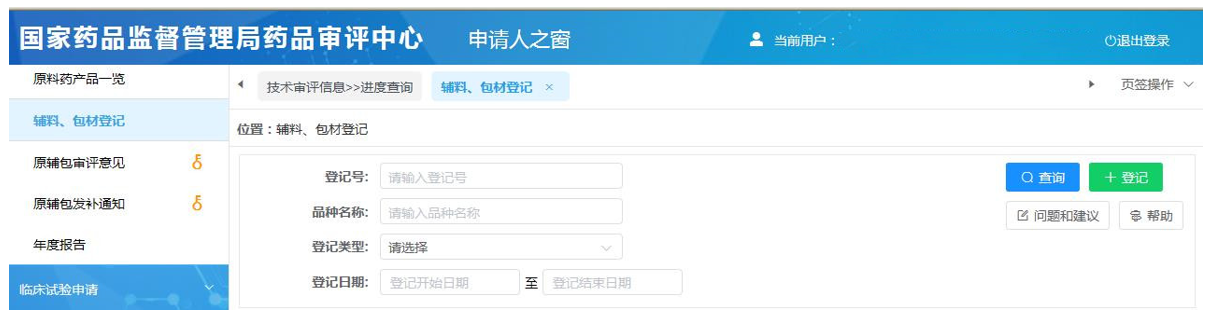
登录后,在左侧找到《技术审评信息》中"进度查询"一栏,找到"辅料、包材登记"。然后点击右侧绿色"+登记"创建登记信息。
二、 信息填报
登记号创建后,按照《原料药、药用辅料和药包材申报登记表》要求进行信息填报。
1、申明
《原料药、药用辅料和药包材申报登记表》要求申报人保证:①本登记表内容及所提交资料均真实、来源合法,未侵犯他人权益,其中试验研究的方法和数据均为本产品所采用的方法和由本产品得到的试验数据。②一并提交的电子文件与打印文件内容完全一致。如查有不实之处,我们承担由此导致的一切法律后果。这部分,申报人不需要填写什么,直接可跳过去。
2、申报事项
2.1、对于"本申报属于:产品来源:○国产○进口○港、澳、台"选择"进口";对于"本申报属于:○原料药○药用辅料○药包材"选择药用辅料。对于"本申报属于:○首次登记○已登记产品重大变更已有登记号"选择首次登记。然后根据药用辅料的特性选择"本药用辅料属于:○高风险药用辅料○低风险药用辅料"、"来源:□动物或人□矿物□植物□化学合成□其他"、"辅料分类:国内外批准制剂中未有使用历史的,且○1.1新的分子结构的辅料以及不属于第 1.2、1.3的辅料;○1.2由已有使用历史的辅料经简单化学结构改变(如盐基,水合物等);○1.3两者及两者以上已有使用历史的辅料经共处理得到的辅料;○1.4已有使用历史但改变给药途径的辅料。国内外批准制剂中已有使用历史的,且○2.1中国药典 /USP/EP/BP/JP均未收载的辅料;○2.2USP/EP/BP/JP已收载,但未在国内上市制剂中使用的辅料;○2.3USP/EP/BP/JP已收载,中国药典未收载;○2.4 中国药典已收载的辅料。在食品或化妆品中有使用历史的辅料,且○ 3.1 具有食品安全国家标准的用于口服制剂的辅料;○ 3.2具有化妆品国家或行业标准的用于外用制剂的辅料。○其他";对于"拟用制剂给药途径:□注射□吸入□眼用□局部及舌下□透皮□口服□其他"根据实际情况进行选择。这部分也是比较简单,只要申报人员对产品比较熟悉,都很容易。
2.2、对于品种情况"产品中文名称:产品英文名称:规格:包装:"部分。这部分也是比较简单,只要申报人员对产品比较熟悉,都很容易。
2.3、对于质量标准情况"○采用国家标准(是否有修订○是○否);来源:○中国药典:版○生物制品规程:版;○局颁标准:册 标准号:○其它:○国外药典标准及版次:○企业标准",根据实际情况填写即可。
2.4、对于专利情况,如果没有专利,不填写;如果有专利,则按照要求填写,即选择"□有中国专利"或□有外国专利"。如果选择"□有中国专利",还要继续选择"□化合物专利□工艺专利□处方专利□其他专利"的专利类别,同时需要填写专利号、专利权人和专利授权。如果选择"□有外国专利",只需要填写专利号、专利权人和专利授权。不管是选择"有中国专利"还是"有外国专利",都需要进行"专利权属声明",即"我们声明:本申报对他人专利不构成侵权"。这部分对于注册人员来说,需要和其他部门或者被代理公司进行沟通。
2.5对于"产品所有权人及生产企业"这部分来说,需要代理结构和被代理机构密切沟通。
首先,对于"产品所有权人"要根据实际情况填写"被代理人的相关信息",即"国家或地区、中文名称、英文名称、社会信用代码/组织机构代码/身份证号、法定代表人、职位、注册地址、通讯地址、邮编、产品质量负责人、职位、联系人、职位、电话、传真、电子信箱、手机、法定代表人(签名)、(加盖公章处)年月日"。这部分内容一定要由被代理人确认;再确认之后才能确定。特别是与提供的佐证资料要进行确认。
其次,对于"生产企业"要根据实际情况填写,即"国家或地区、所在省份(国产企业填写)、中文名称、英文名称、社会信用代码/组织机构代码/身份证号、法定代表人、职位、生产地址、邮编、通讯地址、邮编、产品质量负责人、职位、联系人、职位、电话、传真、电子信箱、手机、药品生产许可证编号、是否具有相应 GMP证、法定代表人(签名)、(加盖公章处)年月日"。这部分对于注册人员来说,也需要和其他部门或者被代理公司进行沟通。
再次,对于"境内全权代理机构"这部分内容来说,很简单的。即"所在省份、中文名称、英文名称、社会信用代码/组织机构代码/身份证号、法定代表人、注册地址、通讯地址、产品质量负责人、职位、联系人、职位、电话、传真、电子信箱、手机、法定代表人(签名)、(加盖公章处)年月日"。
最后,对于"委托研究机构"部分内容。如果没有,不填写。如果有,按照要求填写"序号、研究项目、研究机构名称、研究负责人、联系电话"。这部分,也是很简单的,不过需要代理人和被代理人进行沟通确认。
三、 提交
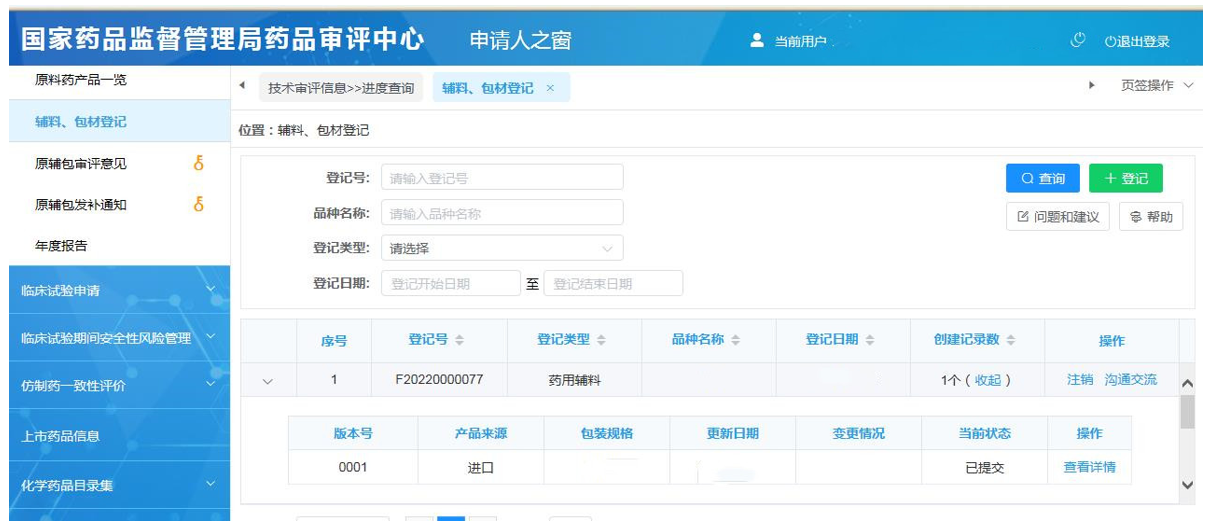
一旦"信息填报"部分完成,则点击"提交"进行提交。一旦提交,在左侧找到《技术审评信息》中"进度查询"一栏,选择"辅料、包材登记"就可以看到登记状态(当前状态"为已提交。
四、 申报
将已提交的"原料药、药用辅料和药包材申报登记表》下载后,发给被代理机构,由其法定代表人在"产品所有权人"和"生产企业"的"法定代表人"处签名并填写日期后加盖公章。同时,代理机构的法定代表人在"境内全权代理机构" 的"法定代表人"处签名并填写日期后加盖公章。
一旦将《原料药、药用辅料和药包材申报登记表》按照要求处理完。把登记表和根据《国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告(2019年第56号)》的附件2药包材登记资料要求(试行)准备的资料,一起刻盘,进行申报。重点提醒:食品药品监管总局发布的《关于发布药包材药用辅料申报资料要求(试行)的通告》(2016年第155号)已于2019年7月15日废止了。
对于《药包材登记资料要求(试行)》所要求的资料,按照其要求进行准备就可以了。如果资料准备的比较充分,可能一次申报成功;如果一次申报不成功,按照药品监督管理局药品审评中心的审评意见及时提供补发资料。
作者简介:老陈,质量管理专家,从事食品与制药行业质量管理和质量控制相关工作近二十年,历任QA主管、质量部长、质量经理和生产厂长等职。在国内著名的跨国明胶企业负责质量和食品安全管理体系管理工作。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57