相容性的研究基本上涵盖于药品生命周期的全过程,近几年来对于相容性的要求也在提高,在药品生产、储存及使用过程中直接接触产品的材料与产品之间是否发生了迁移和吸附等,进而影响到了有效性和稳定性,或者产生了安全性风险。相容性整体的研究并不会在常规的放行和稳定性中进行,往往是需要特殊关注和研究的。在相容性研究的过程中经常会提到可提取物和浸出物这两个名词。可提取物是指在较实际操作环境更为严苟的受控条件下,即最差条件下,从材料中所提取的化学实体,针对可提取物我们往往会研究建立内部的数据库。而浸出物针对的是需要进行浸出物研究的相关的工艺点,对于在正常工艺条件下,与材料接触迁移到工艺流中的化学实体。可提取物是包括浸出物的。
相容性对于保证产品安全性和有效性起着非常重要的作用,又是特殊需要考虑的,同时我们也可以通过一引起不良反应来进一步来发现与材料相容性的关系。
像抗体类药物很多会使用到表面活性剂,如果在包装过程中使用的胶塞是裸塞的话,就有可能会发生浸出反应,有微量的硫化剂浸出,而导致一些慢性肾衰竭、再生障碍性贫血的发生概率升高。所以就任何产品,如果有加入一些表面活性剂的情形下,都不会直接使用裸塞,基本上都会采用覆膜塞的形式阻止浸出物的迁移。
此外生物制品一般附加值比较高,为了增加使用的便利性,很多都会使用预灌注装置。有相关报道说,预灌注射器所使用的硅油能导致蛋白的聚体的产生。现在生物制品有许多都采用一次性的反应器,由于一次性反就器在37℃时还有搅拌存在,使用时间也比较长,往往会多于7天,所以在相容性研究中,风险等级也是比较高的,后续的纯化步骤如果能有效的去除浸出物,可能对终产品的安全风险程度会降低。所以在一次性反应器的使用中,对于相容性研究的必要性是有的。
近几年,疫情持续,召回事件时有发生,与相容性有关的事件也不在少数。这些信息都提示我们相容性研究和重要性和必要性。当然我们制药企业是一定要做相容性研究的。此外对于一次性材料的生产厂家、包装材料的生产厂家相容性研究也是要开展的。选择一次用品生产工艺还是选择传统的不锈钢工艺一个重要的考虑因素都是针对于一次性材料的可提取物和可浸出物的研究数据提供的,是否符合监管要求。
整个相容性研究的内容我们以生物制品为例,分为两个方面,主要针对于原液和成品相关的研究,在这个过程中可能会用到西林瓶玻璃材质的,塑料材质、弹性体这个过程,对于工艺组件的相容性研究,包括一次性/多次性使用系统,相关的如搅拌袋、储液袋的相容性研究,过滤器、硅胶管、不锈钢组件、玻璃组件等,另外还有一些给药器具的相容性研究如一次性注射器、雾化器等。
就一次性使用系统来说,相容性研究在一次性使用系统最早是源于血浆袋,由于一次性系统比较灵活,对于多品种共用生产场地变为了可能,并且目前一次性使用系统所占比例也越来越高了。在进行相容性研究前,应对工艺进行深入了解,收集使用相关的材料信息。对于一个新的材料的使用,在供应商筛选过程中就需要介入相容性研究的相关工作,工艺信息与组件相容性信息一同收集,有的材料供应商现在也意识到了这一点,他们前期会做一些相容性研究工作,这些信息我们也可以收集来,后期可能会简化我们的工作,然后再进行相容性风险评估,建立风险维度,生成每一风险维度的风险级别,评出风险级别,针对风险级别进行一些调整,比如说后续有清除步骤,临床剂量和周期用量的调整等,可以根据自己的工艺和品种的材料信息选择一个适用的风险模型。
图片源于作者
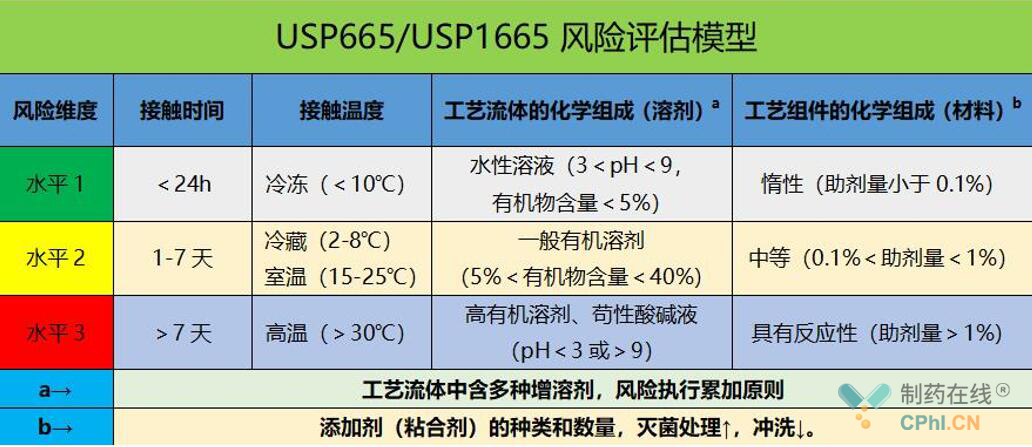
在上表中工艺信息是比较明确的,可根据每一个组件在工艺中具体的使用条件,按4个维度进行打分,如果后期涉及到了工艺变更,在材料选择的过程中,相容性就必须是我们选择的依据之一,在工艺就更过程中,若发生工艺参数的变更,例如反应温度由20℃升高到了50℃,可能也会影响风险级别的判定。
图片源于作者
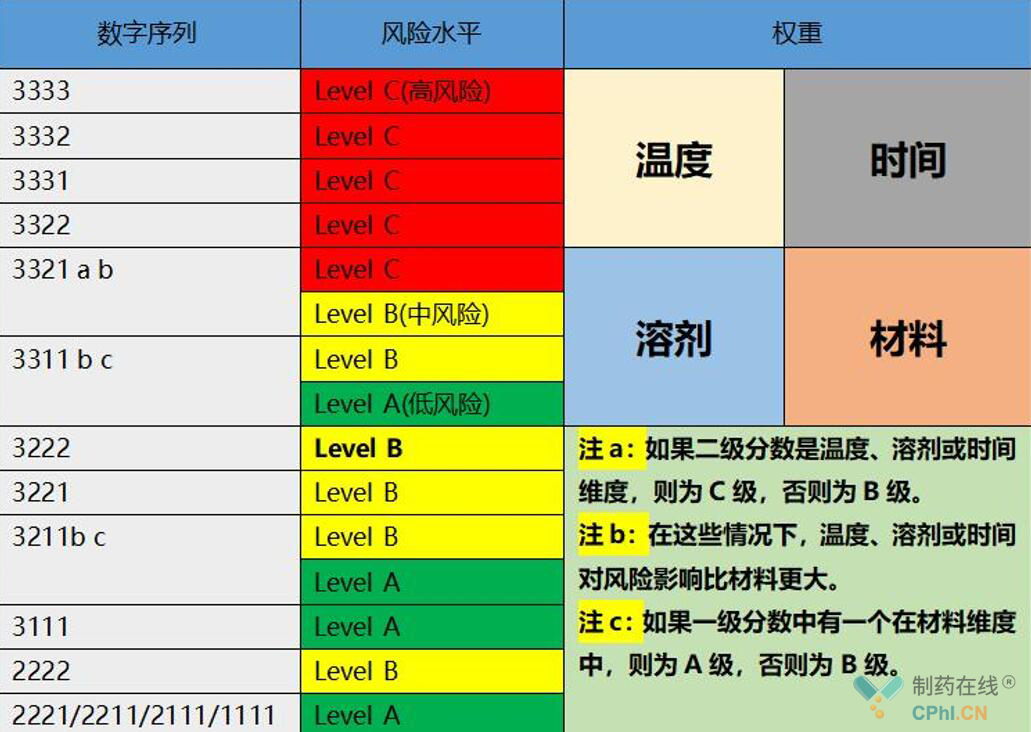
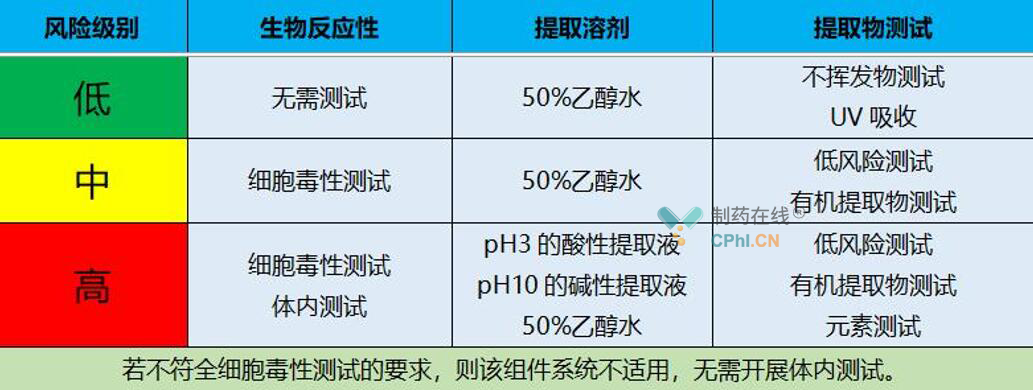
针对温度、时间、溶剂、材料这四个权重来说,温度、时间、溶剂是等同的,都比材料风险更大,所以在整个过程中可以按照这个原则,把前面工艺中所使用的材料,做出一个具体的风险识别,确定风险级别以后,可决定我们到底要开展那相容性试验。可提取物的研究很多时候是在风险评估直接评为一个较低的风险了,不同风险的组件采取的研究策略也不一样,低风险的组件往往只需要基础的化学检测,是不需要进行生物反应性的试验的。针对于低风险和高风险,可能就需要开展一些研究,根据中国药典/ICHQ3C等进行毒理评估,高风险的一次性组件,需要使用代表商业化生产的原料进行浸出物的研究及相关的毒理学测试。
图片源于作者
总结下来就是在项目立项阶段,就应有相容性研究人员参与进来,在IND申报过程中,对于工艺的初步了解也有了概念,这样就有了艺的了解和相关信息的收集,这时就需要开展整个品种的全面的研究策略,通过风险评估的方式,把所有的需要进行相容性研究的组件和材料,设定研究内容。在临床试验阶段如发生工艺变更、第二供应商的增加等情形,制定相应的相容性研究策略,药品上市后,对相容性进行持续的研究,包含有效期全程,对于一些变更的发生,如装量、剂型、新适应症的增加,都有可能涉及重新进行相容性研究。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57