5月18日,百泰生物宣布,其抗EGFR人源化单抗尼妥珠单抗的头颈部肿瘤适应症上市申请已获中国国家药监局药品审评中心(CDE)受理。
EGFR是一个巨大的跨膜糖蛋白,本身具有配体诱导的酪氨酸蛋白激酶活性,它在胃癌、乳腺癌、膀胱癌和头颈部鳞癌等多种肿瘤组织中高表达,EFGR的过度表达与肿瘤的高侵袭力、高转移性及不良预后高度相关。尼妥珠单抗能够竞争性地结合EFGR,阻断由EFGR介导的下游信号传导通路,从而抑制肿瘤细胞增殖、诱导分化、促进细胞凋亡、抑制肿瘤血管生成、增强放化疗疗效。
目前,尼妥珠单抗已经在全球24个国家(美国、德国、加拿大、日本、古巴、印度等)获批头颈部肿瘤适应症,7个国家获批食管癌适应症。在中国,尼妥珠单抗于2008年获批上市,联合放疗用于治疗EGFR表达阳性的Ⅲ期或Ⅳ期鼻咽癌。2022年4月,CDE受理了尼妥珠单抗治疗胰 腺癌的适应症上市申请,基于尼妥珠单抗联合吉西他滨对比吉西他滨治疗KRas野生型局部晚期或转移性胰 腺癌的3期注册临床研究成功地达到预设的主要研究终点。此外,尼妥珠单抗联合放化疗治疗食管癌、宫颈癌、儿童高级别神经胶质瘤、阴茎癌等适应症的注册性多中心临床研究也正在进行中。
头颈部肿瘤通常发生于口腔、鼻咽、口咽、下咽和喉部,其中90%以上的病理学类型为头颈部鳞状细胞癌(SCCHN)。除鼻咽癌以外,SCCHN疾病成因主要与烟草致癌物及乙醇相关,部分口腔癌与嚼食槟榔及烟叶有关,部分口咽癌与人乳头状瘤病毒( HPV)感染有关。由于其病变部位隐蔽,且缺乏特异性症状,早期往往难以发现,60%的患者在确诊时已处于Ⅲ-Ⅳ期,采用手术联合术前或术后放疗仍具有较高的局部复发率和远处转移率,5年总生存率低于50%。根治性放化疗是局部晚期头颈部鳞状细胞癌常用的非手术方法,然而3年总生存率仍然较低。
SCCHN中普遍存在表皮生长因子受体(epidermal growth factor receptor,EGFR)高表达,且与较差的生存预后相关。临床前研究显示,EGFR高表达比低表达的肿瘤具有更强的放射抵抗性,加入抗EGFR单抗后可增加放疗的敏感性,考虑可能与放疗诱导的细胞凋亡增加相关。此外,抗EGFR单抗可通过影响细胞周期、DNA损伤修复及血管生成等多种途径发挥放疗增敏作用。
根据百泰生物早先新闻稿,一项3期随机研究对比了接受尼妥珠单抗加根治性放化疗的患者与仅接受根治性放化疗的患者之间的疗效差异。研究结论显示,在同期放化疗基础上加入尼妥珠单抗,可显著提高局晚期头颈部鳞癌患者无进展生存期(PFS)、局部区域控制(LRC)、中位无病生存期(DFS),降低16%的死亡风险;在同期放化疗基础上加入尼妥珠单抗,可显著改善HPV阴性口咽癌患者的预后;HIF1α高表达是HPV阴性局部晚头颈部鳞状细胞癌对同期放化疗疗效反应差的预测因子,在同期放化疗基础上加入尼妥珠单抗,HPV阴性局部晚头颈部鳞状细胞癌患者显著获益。
EGFR单抗国内外研发情况
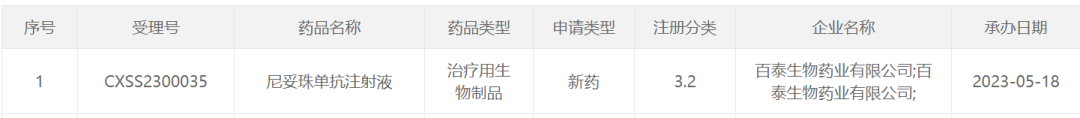
目前全球上市的EGFR单抗有四款,适应症覆盖头颈肿瘤、结直肠癌、非小细胞肺癌等。其中默克的西妥昔单抗和百泰生物的尼妥珠单抗分别于2006年和2008年在中国获批上市,市场竞争力度较小。
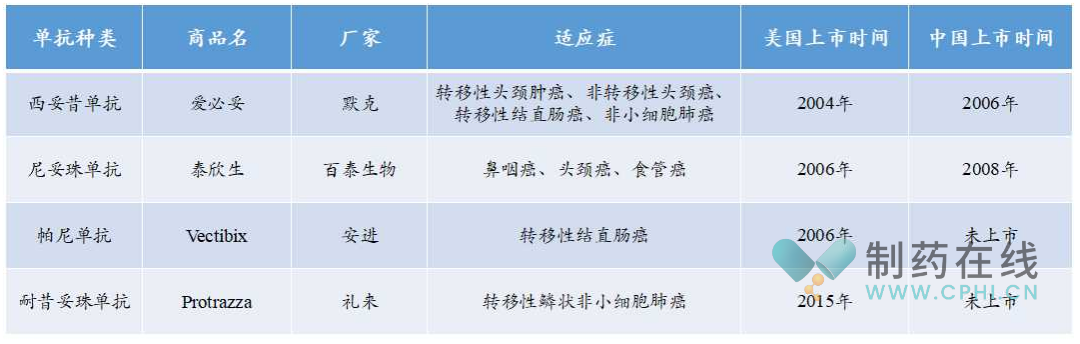
已上市靶向EGFR单抗整理
据Frost & Sullivan 报告,2014年到2018年,我国头颈癌患年新增病例从12.5万人增长至13.7万例,2023年预计会增至15.2万人;而结直肠癌患病人数,从2018年到2023年,预计年新增病例将由42.4万上升至48.9万,其中,KRAS野生型占比为53%到65%。平均下来,中国每年都会新增超过25万例适用EGFR单抗的患者。
两个小癌种每年适用EGFR单抗的患者总数将超过40万,同时EGFR在多种实体瘤存在突变现象,具备广谱靶点的特质。EGFR在多种癌种中均出现高表达,头颈鳞癌中高表达比例在90%以上,肺癌中高表达比例为30%到80%,食管癌中比例为43%到89%。如果未来EGFR单抗开发出更大的适应症,必然将成为重磅单品。
据不完全统计,当前国内至少有8家企业正在开发EGFR单抗,绝大部分为西妥昔单抗生物类似物,只有迈博泰科的CMAB009和复宏汉霖的HLX07这两款属于创新性生物药,其中迈博泰科的CMAB009注射液已于今年3月14日向NMPA递交上市申请。
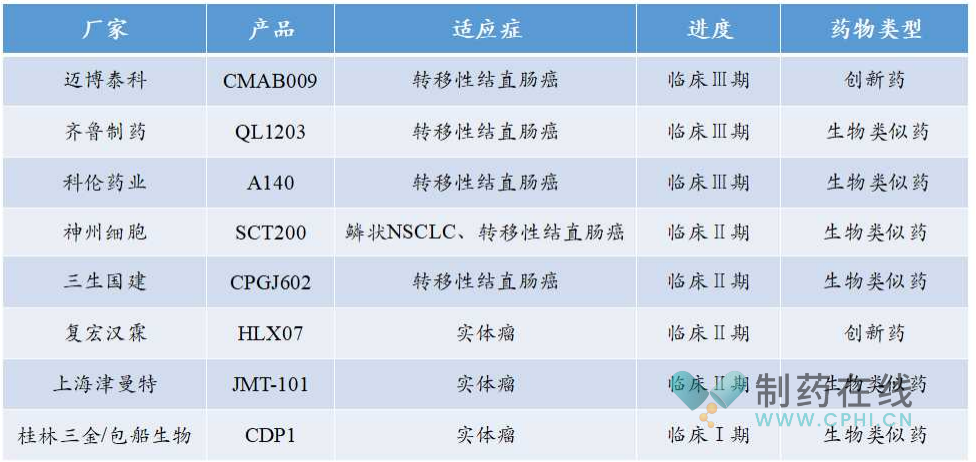
国内EGFR单抗研发概况
CMAB009
CMAB009是迈博泰科研发的一种重组抗表皮生长因子受体( EGFR)嵌合单克隆抗体,是基于西妥昔单抗的全新候选药物,与FOLFIRI联合用于转移性结直肠癌(mCRC)的一线治疗,是首 个向国家药监局申请NDA的用于结直肠癌治疗的中国国产抗EGFR单克隆抗体药物。CMAB009利用中国仓鼠卵巢细胞(CHO)表达系统,该系统不同于已上市的西妥昔单抗产品所使用的小鼠骨髓瘤细胞SP2/0表达系统。
根据临床试验结果与已上市的西妥昔单抗产品已公布临床试验结果的比较,CMAB009较已上市用于治疗mCRC的西妥昔单抗药物同样有效且显著降低免疫原性并减少严重超敏反应等不良反应的发生。未来预计适应症有望拓展到头颈部鳞癌等癌种。
HLX07
HLX07是复宏汉霖自主研发的针对EGFR靶点的创新型生物药,利用抗体改造平台,在西妥昔单抗的基础上,通过将HLX07的Fab区人源化,同时使该产品聚糖含量降至最低,以具备更低的免疫原性和良好的靶点亲和力。HLX07联合斯鲁利单抗用于复发或转移性头颈部鳞状细胞癌(HNSCC)、EGFR高表达鳞状非小细胞肺癌(sqNSCLC)等多种实体瘤治疗的II期临床研究已于中国完成首例患者给药;HLX07联合斯鲁利单抗贝伐珠单抗一线治疗晚期肝细胞癌(HCC)的Ⅱ期临床试验申请已获国家药品监督管理局(NMPA)批准。
参考来源
1.Nimotuzumab plus chemoradiotherapy versus placebo plus chemoradiotherapy in patients with locally advanced nasopharyngeal carcinoma (NPC): A prospective, randomized-controlled, double-blinded, multicenter phase III clinical trial.
2.Nimotuzumab plus concurrent chemo-radiotherapy versus chemoradiotherapy in unresectable locally advanced esophageal squamous cell carcinoma (ESCC): Interim analysis from a prospective, randomized controlled, double-blinded, multicenter, and phase III clinical trial (NXCEL1311 Study).
3.Anti-EGFR antibodyplus anti-PD-1 antibody and chemotherapy as a neoadjuvant regimen for patientswith locally-advanced penile squamous cell carcinoma: A prospective,single-arm, single-center, phase II clinical trial.
4.van Erning FN, Mackay TM, van der Geest LGM, et al. Oncol. 2018 Dec;57(12):1655-1662.
5.Schultheis B, et al. Ann Oncol. 2017 Oct 1;28(10):2429-2435.
6.CDE官网
7.百泰生物官网
8.复宏汉霖官网
9.迈博药业官网



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57