3月12日,美国FDA公布了一则召回信息。一款曲前列尼尔注射液因为含有有机硅颗粒而召回,颗粒可能引发局部肿胀刺激,如果到达血管,则可能进入各器官,阻塞心脏、肺、大脑血管等,引发中风或死亡。

图源 FDA
就曲前列尼尔注射液而言,用于治疗肺动脉高压,以减轻运动引起的相关症状。我国只有两家企业兆科药业和广东星昊药业注册,共三个文号。
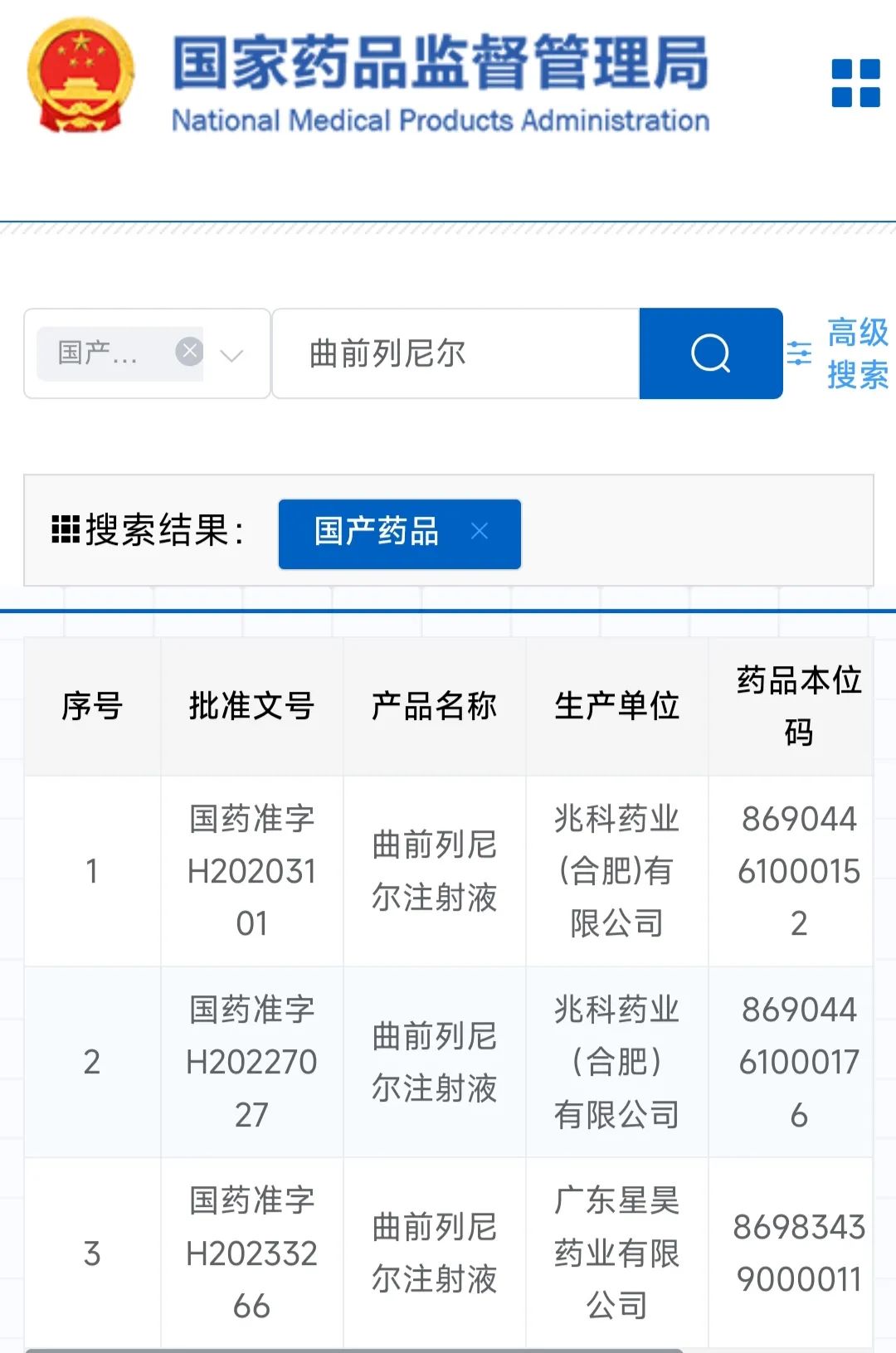
图源 药监局
本身应用于肺部疾病的药物,如果颗粒加重病情,那就得不偿失了。这批药从2022年6月后分发到医疗机构和经销商,2024年4月份就要到期了,结果三月份才发现问题。有可能是颗粒非常少,非专业人士借助设备难以发现。

图源 FDA
药品注射液中出现的有机硅颗粒可能来源于多个环节。首先,这种材料广泛应用于各种工业领域。在药品生产过程中,有机硅颗粒可能通过以下途径进入注射液中:
原料与辅料:药品生产过程中使用的原料和辅料可能含有微量有机硅。如果这些原料和辅料未经充分处理或筛选,其中的有机硅颗粒可能会随之进入注射液。
生产设备:制药设备中的硅胶管、密封件等可能含有有机硅成分。长时间使用或维护不当可能导致这些部件磨损,释放出有机硅颗粒,进而污染药品。
生产环境:制药车间内的空气、水、地面等也可能受到有机硅污染。如果生产过程中的空气净化、水处理等措施不到位,有机硅颗粒可能通过空气或水进入药品。
包装材料:药品的包装材料,如玻璃瓶、塑料瓶等,清洗不到位或者有缓慢逸出,也可能含有微量有机硅。如果包装材料的选择或使用不当,有机硅颗粒可能在包装过程中进入药品。考虑到是单一批次问题,应该不是材料本身的因素。
为了减少药品注射液中有机硅颗粒的出现,制药企业需要采取一系列措施:
严格筛选原料和辅料,确保其不含有害物质。定期对制药设备进行维护和更换,确保设备处于良好状态。加强生产环境的监控和管理,确保空气、水等符合生产要求。选择合适的包装材料,并对其进行严格的质量控制。
此外,监管部门也需要加强对药品生产企业的监管和检查,确保药品质量和安全。
为了确保药品的安全,制药企业需要严格控制生产过程中的各个环节,以防止硅颗粒或其他污染物进入药品。这包括使用高质量的原料和辅料、定期维护和检查生产设备、保持生产环境的清洁和卫生,以及选择合适的包装材料等措施。
如果药品中检测到了硅颗粒,制药企业需要立即进行调查,找出污染来源,并采取必要的纠正措施,以确保药品的质量和安全。同时,监管部门也需要加强对药品生产企业的监管和检查,确保企业遵循相关法规和标准,保障公众用药安全。
从时间上看,一般药物不会到临近效期才开始用,所以该批次可能已经在临床上消耗殆尽。尽管没有反馈问题,但企业在自查中发现问题,还是发生召回,是非常负责的态度。尽管召回的量,可能很小,却已经做到了有错就纠正。再就是明知后续的问题调查,可能会非常繁琐,却依旧选择对外揭丑,这种魄力是很难得的。过于这种勇于担当的态度与觉悟,正是相关监管方严查追责的一种结果。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57