当地时间2月26日,美国FDA公布了一则药品召回信息。一家药企,因为多个批次多个品牌的眼药膏产品缺乏无菌保证而发起召回。

图源 FDA
这些眼药膏生产日期跨越一年多,包含4种,共25个批次,其中多个批次,如A2L02/A2L03/A2L04、A3J17/A3J18是连续批次。
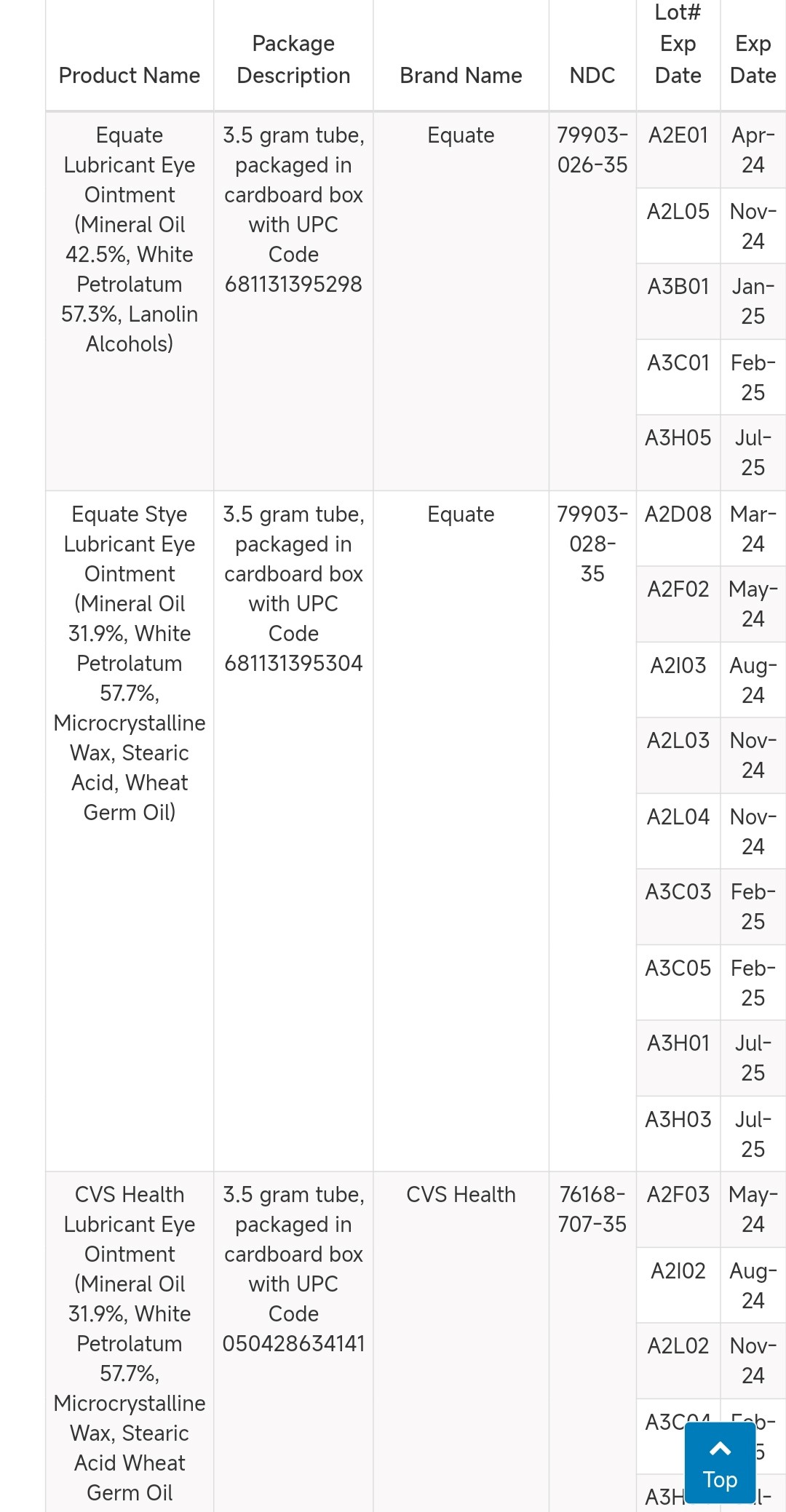
图源FDA
和其他企业的在留样检查中发现问题而召回不同,这次召回是因为监管机构发现药企的生产设备缺乏无菌保证。也就是说,生产中设备可能没有在线灭菌;也可能灭菌设备有缺陷,导致有盲点。
这次并没有告知具体污染的微生物菌株是哪一种,也可能本身就是多种杂菌,那样的话鉴定起来就有一个时间差,在无法明确菌种的时刻只能先行召回。
当然还有一个可能就是在明确生产设备有染菌风险后,并未在留样药品中发现有染菌。在市面上销售的药品里也没发现超规的不良事件,所以无法找到到底哪些有被污染。
鉴定出具体的污染菌株,是一些无菌制剂企业的操作,因为通过菌株的生存环境以及分布区域,可以判断出其来源。是水还是空气,是人体皮肤表面还是粪便,是人的口腔鼻腔还是化脓的伤口?
在至少一年多的时间里,企业放任这种污染风险继续生产,可能是能力不足,也就是自己无法察觉到这种风险。常规的清洁灭菌验证中,未能发现问题。或者说根本验证就是走形式,为了保证验证通过考核,全部都以最严标准实施,不是正常的生产状态。一些风险在其他超规格的因素干扰下,无法体现出来。
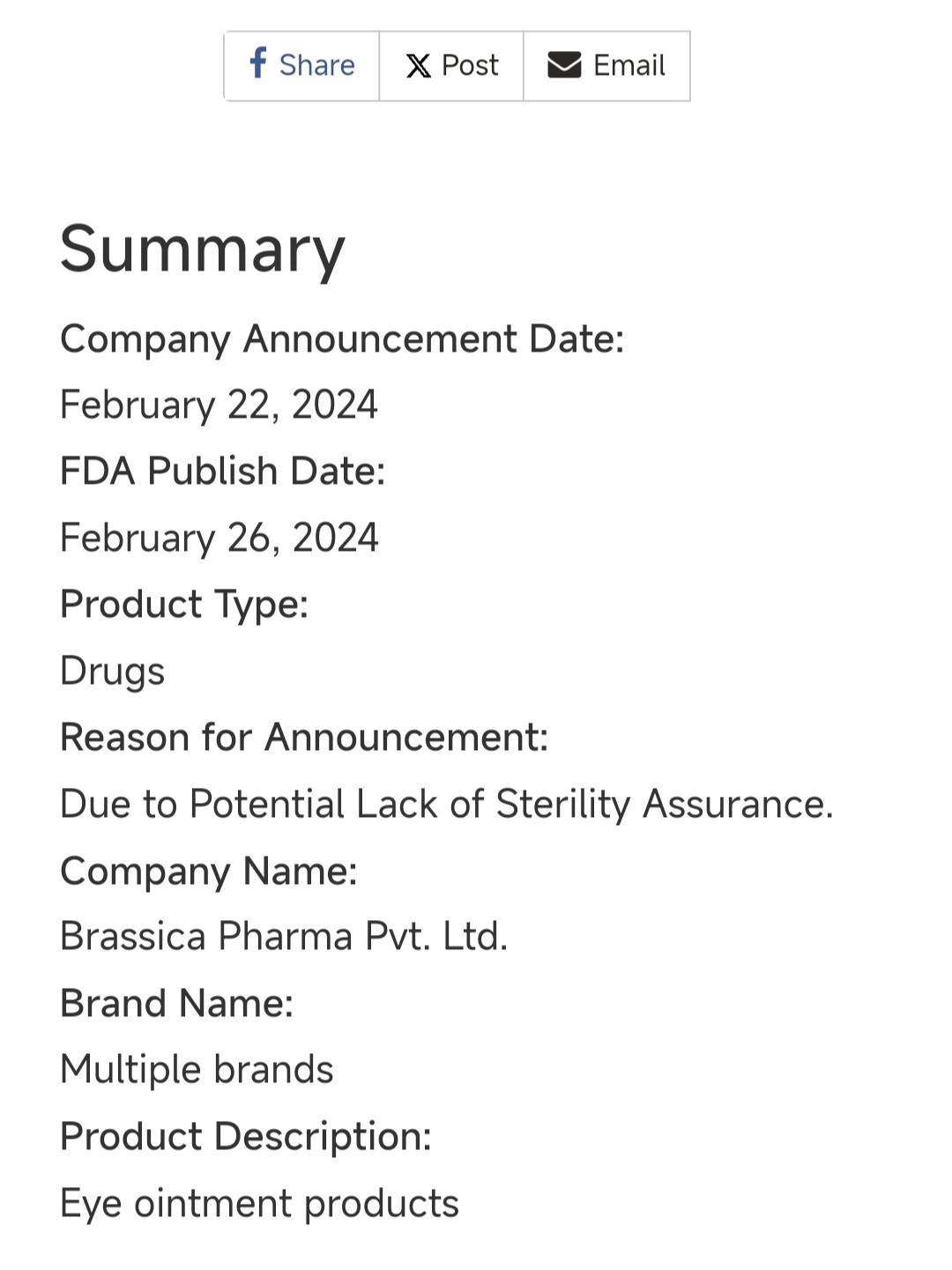
图源 FDA
再就是企业意识到了风险,但无法做到完善,而且被污染的药品存在随机性和概率性,不是百分百被污染。全部杜绝后患可能需要大规模的更换生产设备,投资较大,无法督促领导层实施。为了保证继续生产,在没有彻底排除风险下,只能装作不清楚风险。因为意识到可能会在后续的官方检查中发现缺陷,所以刻意增加产能,在短时间内大量生产投放市场。当然这一点属于有罪推定,很多时候给出的资料数据有限,是无法判断出企业到底是没发现问题还是刻意隐瞒问题的。
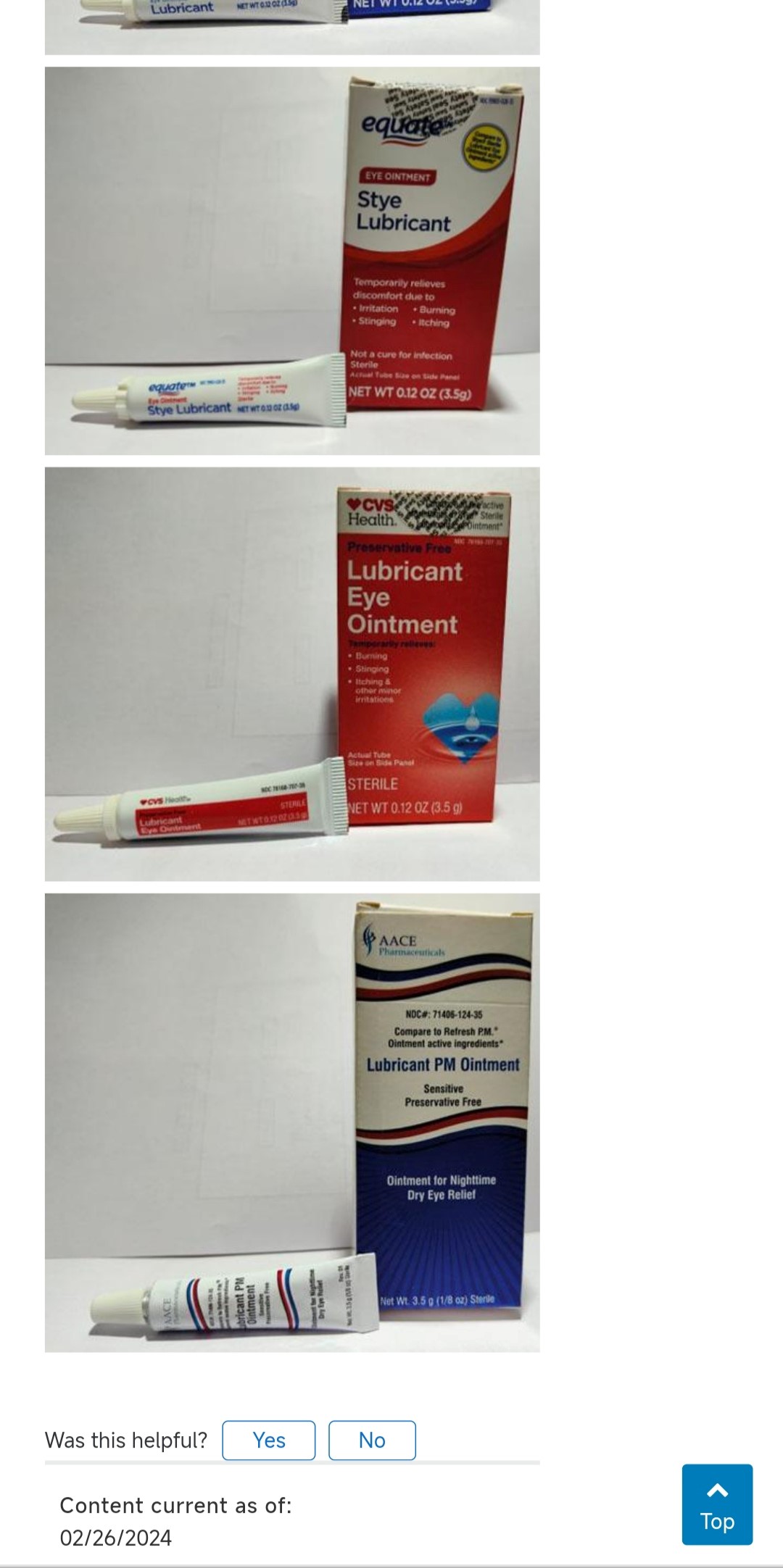
图源 FDA
在FDA历史数据中,亚洲区域数据造假是全球首位的,尽管没有明确,但考虑到市场份额以及合作区域,有网友推测这个首位可能真的是印度企业带起来的。本次事件中就是印度药企,在以前也发生过印度眼药水被绿脓杆菌污染,从而造成人员死亡和加重病情,最终全部召回的事件。有网友认为其绿脓杆菌来源,可能与人员手部清洁不彻底有关。
眼药水眼药膏都是需要对无菌有苛刻要求的,所以我们在使用时都有提示不要瓶口直接到眼部,为的就是避免污染到瓶内制剂。尽管一瓶的开盖后使用时长不多,但依然要考虑到这种风险。而生产环节中带来的污染,在储存期内可能微生物大量增殖,则是会加重这种对人体伤害的影响性。
无菌需要多重因素来保障,原料、人员清洁保护、车间环境、生产设施适用性等等缺一不可。被污染只是一种结果,发现了某一因素不合格会引发污染,并不意味着一定只是这一个因素引发,也可能是多因素合并引发,只不过孰轻孰重不同而已。无菌制剂,还是要谨慎行事。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57