7月3日,再生元和赛诺菲联合宣布,双方共同开发的IL-4Ra/IL13抗体药物--度普利尤单抗(Dupilumab,商品名:达必妥,Dupixent)获欧洲药品管理局(EMA)批准, EMA也是全球首个批准度普利尤单抗用于COPD患者的监管机构。本次获批适应症为以血嗜酸性粒细胞水平升高为特征且未得到控制的慢性阻塞性肺病(COPD)患者的附加维持治疗,治疗患者涵盖了既往联用吸入性皮质类固醇(ICS)、长效β-2激动剂(LABA)和长效毒蕈碱拮抗剂(LAMA)的患者,或者在ICS不适用情况下,联用LABA和LAMA的患者。
7月3日,再生元和赛诺菲联合宣布,双方共同开发的IL-4Ra/IL13抗体药物--度普利尤单抗(Dupilumab,商品名:达必妥,Dupixent)获欧洲药品管理局(EMA)批准, EMA也是全球首个批准度普利尤单抗用于COPD患者的监管机构。本次获批适应症为以血嗜酸性粒细胞水平升高为特征且未得到控制的慢性阻塞性肺病(COPD)患者的附加维持治疗,治疗患者涵盖了既往联用吸入性皮质类固醇(ICS)、长效β-2激动剂(LABA)和长效毒蕈碱拮抗剂(LAMA)的患者,或者在ICS不适用情况下,联用LABA和LAMA的患者。


本次是获批是基于度普利尤单抗开展的两项COPD关键性III期临床:BOREAS研究和NOTUS研究。两项试验均达到了主要终点,52周试验期间,度普利尤单抗显著降低了中度或重度急性COPD加重的年化发生率,并且有效改善了肺功能。
BOREAS研究是一项多中心、随机、双盲、安慰剂对照的III期临床研究,旨在评估度普利尤单抗在伴2型炎症特征的中重度慢阻肺病患者中的疗效、安全性和耐受性。主要临床终点52周试验期间COPD中度或重度恶化的年发生率,研究结果显示,Dupilumab组的COPD中度或重度加重年化率0.78(95% [CI],0.64-0.93),安慰剂组为1.10(95% CI,0.93-1.30)。
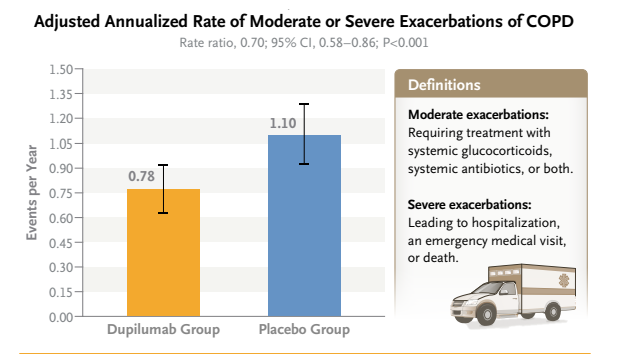
NOTUS研究共入组935名患者,其中470例接受Dupixent治疗,研究评估了Dupilumab作为辅助维持治疗对未受控制的COPD成人患者的临床疗效,患者既往接受过最大标准护理吸入疗法(几乎全部接受三联疗法)并有2型炎症证据(即血液嗜酸性粒细胞≥300个细胞/μL)。研究达到主要临床终点,与安慰剂相比,Dupixent显著减少了34%的急性COPD发作,并改善了肺功能。
3. Dupilumab for COPD with Type 2 Inflammation Indicated by Eosinophil Counts[J]. N Engl J Med. 2023 Jul 20;389(3):205-214.






![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57