4月15日,根据CDE官网公示信息,吉利德(Gilead)公司申报的Seladelpar胶囊临床试验申请获得受理。Seladelpar最早于2024年8月14日获FDA批准上市,用于联合熊去氧胆酸(UDCA)治疗UDCA应答不足的PBC患者,或作为单药治疗UDCA不耐受的患者。
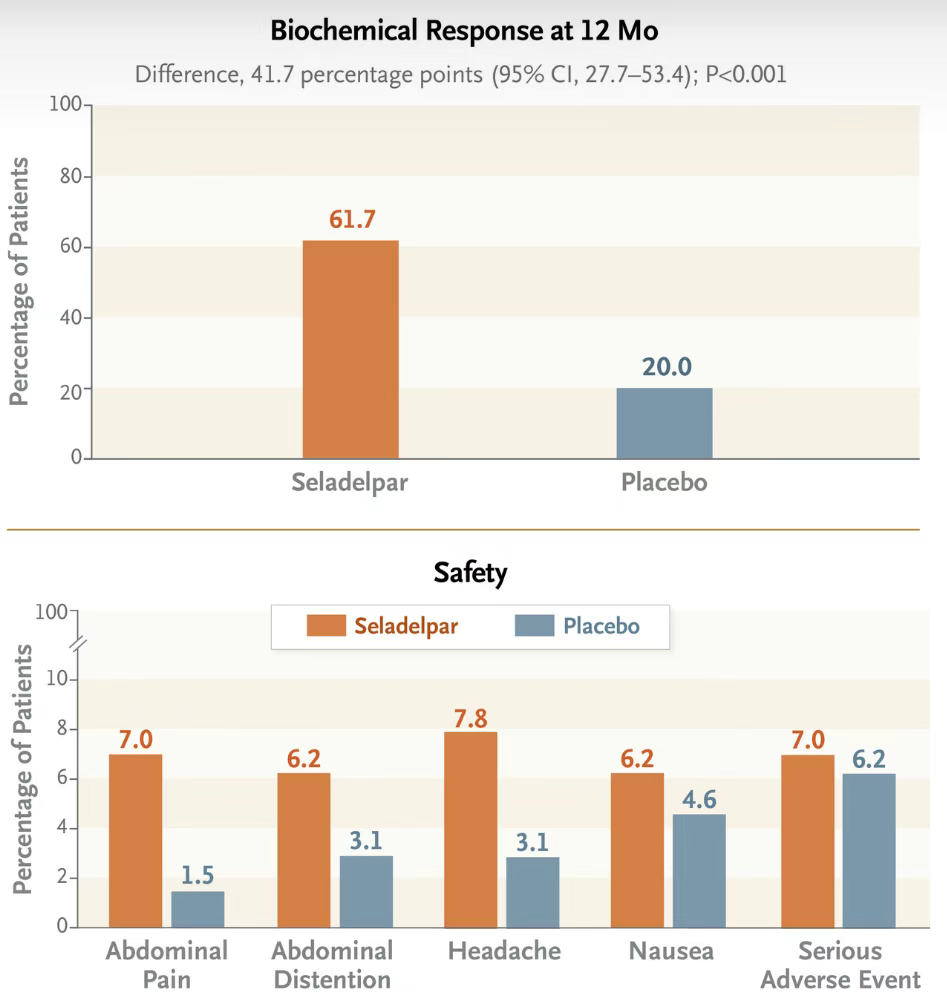
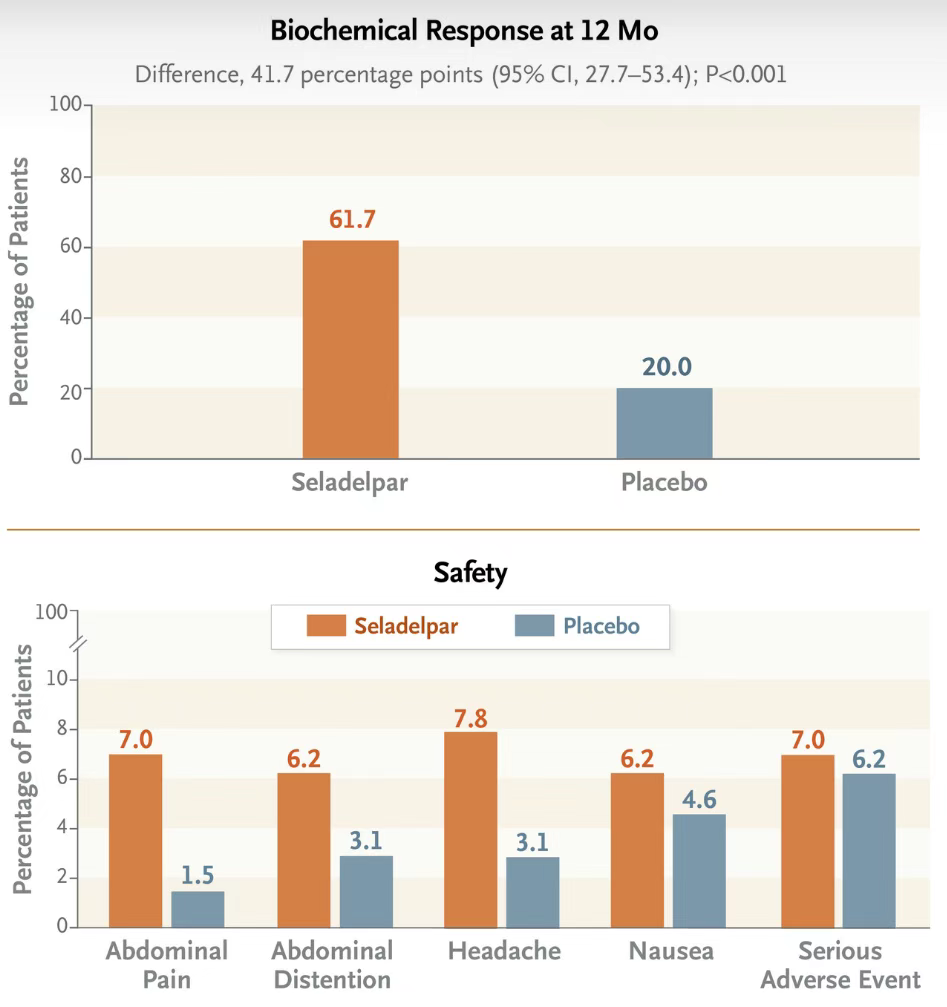
Seladelpar是选择性PPAR-δ激动剂,抑制胆汁酸合成的关键酶CYP7A1的表达,从而减少胆汁酸的合成和分泌,此外,PPAR-δ的激活还可调节脂质代谢,降低低密度脂蛋白胆固醇(LDL-C)和甘油三酯(TG),并提升脂肪酸氧化标志物。Seladelpar原研公司CymaBay Therapeutics,2024年2月12日,吉利德宣布与CymaBay Therapeutics达成并购协议,吉利德将以每股32.5美元或总股本价值43亿美元的价格收购CymaBay,从而获得了该产品。Seladelpar此前获批上市基于关键性临床3期RESPONSE的研究结果,在193例接受随机分组和治疗的患者中,93.8%的患者既往接受了熊去氧胆酸作为标准治疗。Seladelpar组患者出现生化反应的比例高于安慰剂组,两组分别为61.7%及20.0%(P<0.001)。Seladelpar组患者碱性磷酸酶水平恢复正常的比例也高于安慰剂组(25.0% vs 0%)。与安慰剂组相比,Seladelpar组瘙痒数值评分量表评分下降幅度更大(与基线相比的最小二乘均值变化,-3.2 vs -1.7,P=0.005)。Seladelpar组和安慰剂组报告不良事件的比例分别为86.7%和84.6%,严重不良事件发生率分别为7.0%和6.2%。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57