阿尔茨海默病,俗称老年痴呆症,是一种以进行性认知功能障碍和精神行为损害为特征的中枢神经系统退行性疾病。该病会导致患者智力障碍、精神异常、社会与生活功能丧失,严重影响患者的认知能力和正常生活,是当今社会面临的一大健康挑战。
阿尔茨海默病(Alzheimer’sdisease,AD),俗称老年痴呆症,是一种以进行性认知功能障碍和精神行为损害为特征的中枢神经系统退行性疾病。该病会导致患者智力障碍、精神异常、社会与生活功能丧失,严重影响患者的认知能力和正常生活,是当今社会面临的一大健康挑战。
来源:https://doi.org/10.1093/procel/pwae026
从1906年,一位名叫阿洛伊斯·阿尔茨海默的医生报告首例经解剖的51岁女性阿尔茨海默病患者以来,人们对该病的探索从未停止。然而,由于AD发病机制复杂,迄今为止,科学界仍未完全阐明AD的发病机理,并且在新药研发上,经历了一次又一次失败,因此这一领域被形象地称为“研发黑洞”。好在科学家们从未放弃。如今,黑洞里照进来希望之光。在已获批上市和临床在研药物中,谁将是这条赛道上的黑马?
发病机制不清,新药研发屡战屡败
在探索AD的过程中,科学家提出了多种假说来进行验证,如Aβ级联假说、Tau蛋白异常磷酸化假说、胆碱能假说、氧化应激假说、神经炎症假说、肠道微生物群破坏假说等。其中以Aβ级联放大假说、Tau蛋白异常磷酸化假说、胆碱能假说为主流。
Aβ级联放大假说是指在正常生理条件下,细胞外β淀粉样蛋白(Aβ)的产生与清除处于一个动态平衡的过程,但在病理情况下,Aβ生成增多或者清除减少,导致平衡被打破。这样Aβ在大脑中沉积和积累,导致淀粉样斑块(俗称老年斑)的形成,从而引起大脑中神经元和突触毒性,进一步影响患者的记忆和认知能力。这些病理过程又进一步促进Aβ沉积,从而形成一种级联式放大反应。Aβ级联放大假说是目前最主流的AD发病机制假说。
Aβ级联假说图解
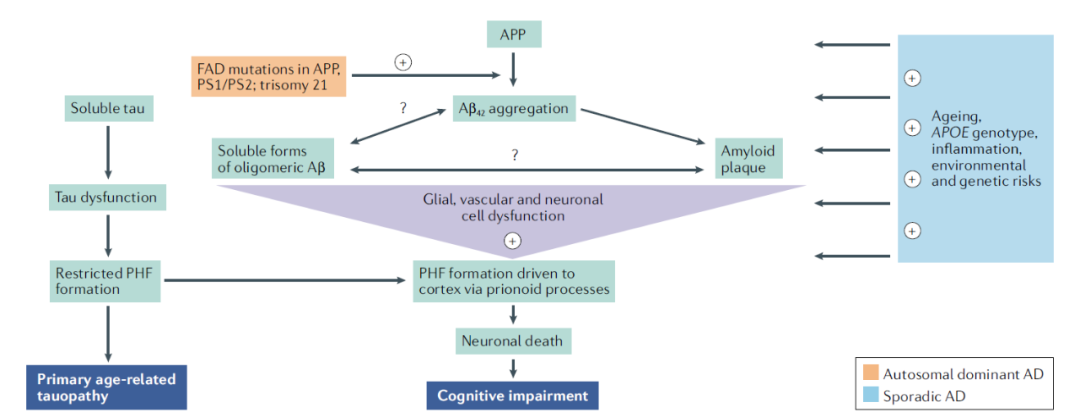
来源:参考1
Tau蛋白异常磷酸化假说中,Tau蛋白是一种微管相关蛋白,通过与微管结合,维持细胞骨架的稳定性。AD患者脑内Tau蛋白过度磷酸化,并聚集形成神经原纤维缠结的主要成分,产生神经毒性;而且正常Tau蛋白的减少还导致微管溃变,神经元死亡等,从而引起AD症状。
胆碱能假说则认为AD患者脑内的神经递质存在缺陷,从而导致胆碱能神经元受到损伤,导致定向力障碍、记忆减退、行为改变等。
值得注意的是,目前并没有哪一种假说得到证实。在此基础上研发的新药大多以失败告终。如强生/辉瑞的Bapineuzumab、默沙东的MK-8931、罗氏的Gantenerumab和Crenezumab等均在临床试验阶段宣告失败。
期间AD治疗市场主要由多奈哌齐、美金刚等症状缓解类药物主导,这些药物仅能缓解症状,并不能阻止AD进展。直到2021年,渤健的Aducanumab(Aduhelm)获FDA加速批准,AD领域长久以来无新药的僵局被打破。
数十年磨一剑,AD新药迎来收获期
2021年6月,渤健的Aduhelm获FDA批准,成为AD领域首个获批上市的靶向Aβ的疗法。Aduhelm选择性识别Aβ构象表位的免疫球蛋白G1(IgG1)单克隆抗体,与患者脑组织中的Aβ沉积结合,激活免疫系统,清除大脑中的沉积蛋白,从而影响AD发病进程。
不过自获批以来,Aduhelm由于副作用等原因一直饱受争议,最终于2024年2月从市场上撤出。上市三年来,Aduhelm遭受了上市受挫、业界质疑、销售团队解散等一系列负面影响。
不过,Aduhelm的失败并没有让渤健放弃AD药物研发。2023年1月,渤健/卫材的另一款产品Leqembi(Lecanemab)获FDA加速批准,并于2023年7月获FDA完全批准。
Leqembi是一种人源化IgG1靶向Aβ单克隆抗体,与Aβ可溶性原纤维高亲和力结合,以中和及清除可溶性β淀粉样蛋白聚集体。
据渤健财报,2023年,Leqembi的年销售额仅为1000万美元;但随着市场的铺设,Leqembi的销售后续快速增长。2024Q1,Leqembi的销售额达到了1900万美元,是2023年Q4的近3倍;另外仅2024年6月,其销售额就达到了1100万美元,超越其在2023年的总销售额。
不过随着礼来新药的上市,Leqembi将面临更大的销售压力。2024年7月2日,礼来的 Kisunla(Donanemab)获 FDA 批准,用于治疗早期症状性AD。Kisunla是除Leqembi外,再次获批上市的一款Aβ抗体。其疗效数据为:治疗76周iADRS(阿尔茨海默病评级量表)延缓下降22%,CDR-SB(临床痴呆评级-框架总和)评分延缓下降29%。
在疗效方面,根据被FDA批准上市的关键性临床研究,Kisunla和Leqembi区别不大,但Kisunla是第一款可以基于淀粉样斑块水平停止治疗的Aβ靶向疗法,这使其将成为Leqembi的劲敌。但渤健/卫材会就此罢休吗?
由于全球人口老龄化加剧,AD患者数量持续升高,据World Alzheimer Report数据,2015年AD患者人数为4680万,预计2030年将增长至7470万,2050年将会达到1.3亿。
巨大的市场前景吸引了国内外一众药企角逐,这些参与其中的药企研发药物的靶点呈现出多元化趋势。不仅如此,渤健/卫材、礼来仍在你追我赶。
2024年5月,渤健/卫材向FDA提交了Leqembi皮下注射(SC)版本的滚动生物制品许可申请。如果获得批准,Leqembi SC自动注射器可以用于在家里或医疗机构给药,注射过程所需的时间比静脉注射制剂少。Leqembi SC的推出,旨在挑战礼来Kisunla可以停药的治疗优势。
这边厢,礼来正在快马加鞭布局下一代Aβ抗体Remternetug,这是一款抗β淀粉样蛋白亚型N3pG的单抗,N3pG Aβ是一种焦谷氨酸化产物,已在2011年被证明与AD密切相关。初期临床研究显示,与Kisunla相比,Remternetug表现出了更好地清除脑内淀粉样斑块的潜力。当前,Remternetug正在进行III期临床研究。值得注意的是,Remternetug采用了静脉注射和皮下给药等灵活给药方式。
在新靶点研发方面,新锐公司Asceneuron正在推进OGA抑制剂ASN51的研发。ASN51是一种口服小分子药物,旨在抑制与蛋白质聚集有关的酶OGA,通过阻止tau蛋白的聚集,以减缓AD进展。目前正在进行AD适应症的II期临床研究。在刚刚过去的7月17日,Asceneuron宣布获Novo Holdings领投,完成1亿美元的超额认购C轮融资,以推进其突破性的OGA抑制剂临床管线的开发。
勃林格殷格翰的Iclepertin(BI-425809)是一款新型甘氨酸转运蛋白1(Gly-T1)抑制剂,可通过抑制GlyT1,提高突触甘氨酸水平,增强N-甲基-D-天冬氨酸(NMDA)受体信号传导,从而增强谷氨酸能神经传递和下游的神经可塑性过程,起到治疗AD的作用。
另外就是大名鼎鼎的GLP-1。研究指出,GLP-1药物在减轻大脑炎症及保护神经元方面具有潜在效果,而炎症在精神、神经系统疾病中的作用已被广泛研究。另外GLP-1除了是调控血糖天然的肠促胰岛素外,也是一种确认的神经递质,其受体在大脑的许多区域均有表达。从2021年起,诺和诺德就启动了两项关于GLP-1R激动剂司美格鲁肽在早期AD患者中的大型III期临床研究。
总之,在研AD新药涉及的病理机制多元,包括神经保护、突触活性及神经传导和炎症等多个方向,得益于这些多元化的探索,未来可能会有更多的创新和突破。那么,这条赛道上谁将是脱颖而出的黑马?业界也在等待答案。
1、The amyloid hypothesis in Alzheimer disease: new insights from new therapeutics. Nature Reviews Drug Discovery, https://doi.org/10.1038/s41573-022-00391-w.
2、中华医学会神经病学分会痴呆与认知障碍学组. 阿尔茨海默病源性轻度认知障碍诊疗中国专家共识2021.中华神经科杂志,2022,55(5):421-440.
3、https://www.biopharmadive.com/news/leqembi-sales-spark-therapeutics-novartis-layoffs-ipsen/721135/.
4、Nørgaard, Caroline Holm et al. “Treatment with glucagon-like peptide-1 receptor agonists and incidence of dementia: Data from pooled double-blind randomized controlled trials and nationwide disease and prescription registers.” Alzheimer's & dementia (New York, N. Y.) vol. 8,1 e12268. 23 Feb. 2022, doi:10.1002/trc2.12268.
5、Asceneuron Secures $100 Million Series C Financing to Advance Groundbreaking Therapeutics in Neurodegenerative Diseases. Retrieved July 16, 2024 from https://asceneuron.com/asceneuron-secures-100-million-series-c-financing/.




![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57