7月25日,美国生物医药公司Checkpoint Therapeutics在其官网宣布,公司核心项目PD-L1抗体药物--Cosibelimab重新提交的BLA申请已被FDA受理,适应症为治疗不适合进行根治性手术或根治性放疗的转移性或局部晚期皮肤鳞状细胞癌(cSCC)成人患者,PDUFA日期为2024年12月28日。
7月25日,美国生物医药公司Checkpoint Therapeutics在其官网宣布,公司核心项目PD-L1抗体药物--Cosibelimab重新提交的BLA申请已被FDA受理,适应症为治疗不适合进行根治性手术或根治性放疗的转移性或局部晚期皮肤鳞状细胞癌(cSCC)成人患者,PDUFA日期为2024年12月28日。此前2023年12月,FDA曾因第三方合同制造组织(CMO)制造问题拒绝了Cosibelimab的BLA,但并未对Cosibelimab的临床数据包、安全性以及说明书表示任何担忧。

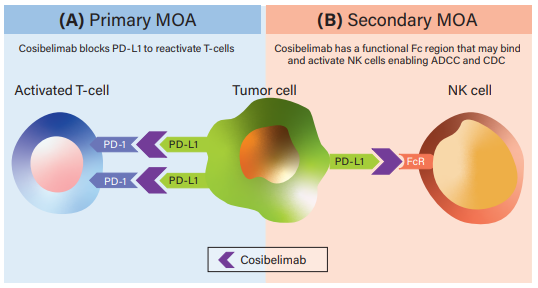
Cosibelimab是一款高亲和力、全人源化IgG1亚型单克隆抗体,其作用机制主要体现在两个方面:一是可直接结合PD-L1并阻断PD-L1与PD-1和B7.1受体的相互作用。从而消除PD-L1对抗肿瘤CD8+T细胞的抑制作用,从而恢复细胞毒性T细胞反应;二是Cosibelimab具有功能性Fc结构域,可能能够诱导针对肿瘤细胞的抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)。
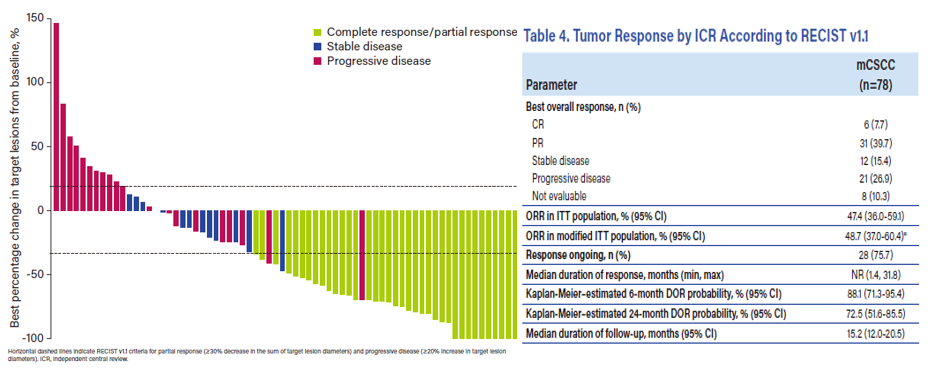
Cosibelimab治疗皮肤鳞状细胞癌的临床数据早在2022年已报道,研究共纳入了78名mCSCC患者,确认客观缓解率(ORR)为47.4%(95% CI:36.0,59.1)。2022年6月,临床中期分析结果,根据对队列中31名患者的独立中央审查,确认ORR为54.8%(95% CI:36.0,72.7),超过了95%双侧置信区间25%的临床意义下限。
参考文献:
1. 2022年ASCO:Efficacy and Safety of Cosibelimab, an Anti–PD-L1 Antibody, in Patients With Metastatic Cutaneous Squamous Cell Carcinoma: Results From Pivotal Cohort
2.https://ir.checkpointtx.com/news-events/press-releases/detail/93/checkpoint-therapeutics-submits-biologics-license





![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57