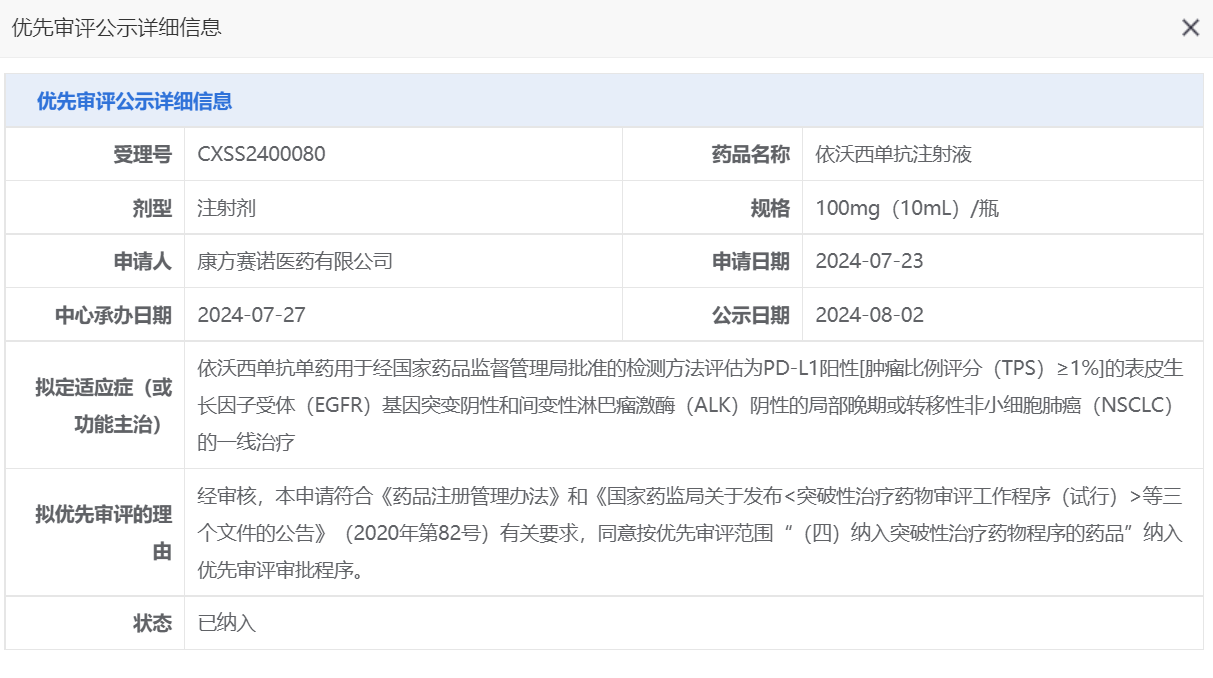
8月14日,国家药品监督管理局药品审评中心(NMPA CDE)官网公示显示,康方生物(9926. HK)全球首 创新药依达方®(通用名:依沃西单抗注射液)(PD-1/VEGF双抗,AK112)被纳入优先审评品种名单。该适应症的上市申请是基于HARMONi-2(AK112-303)研究。
7月29日,依沃西该项适应症的新药上市申请(sNDA)获得了CDE的受理。
图片来源:康方生物官微
这是依沃西单抗第二个被授予优先审评资格的适应症,也是依沃西单抗临床价值被认可的重要体现。
由独立数据监察委员会(IDMC)针对HARMONi-2进行的预先设定的期中分析显示强阳性结果,在意向治疗人群(ITT)中,依沃西单抗单药相较于帕博利珠单抗单药显著延长了患者无进展生存期(PFS),风险比(HR)显著优于预期。依沃西成为全球迄今唯一在单药头对头III期临床研究中证明疗效显著优于帕博利珠单抗的药物。
依沃西是康方生物独立自主研发的、全球首 创新一代肿瘤免疫治疗新药,2024年5月,依沃西联合方案治疗EGFR-TKI进展的EGFR突变的非鳞NSCLC适应症的上市申请在优先审评条件下获得批准上市,成为全球第一个获批上市的“肿瘤免疫+抗血管生成”机制的双特异性抗体新药。
关于依达方®(PD-1/VEGF双抗,依沃西)
依达方®(依沃西单抗注射液)是本公司自主研发的、全球首 创PD-1/VEGF双特异性肿瘤免疫治疗药物。依达方®于2024年5月获得中国国家药品监督管理局批准上市,用于EGFR-TKI治疗进展的局部晚期或转移性nsq-NSCLC。依达方®是全球首 个获批上市的“肿瘤免疫+抗血管生成“协同抗肿瘤机制的双特异性抗体新药。
目前,依达方®单药对比帕博利珠单抗单药一线治疗PD-L1表达阳性的晚期NSCLC的III期研究在期中分析中达到了无进展生存期的主要研究终点,获得决定性胜出阳性结果。基于此项研究,依达方®单药一线治疗PD-L1表达阳性的晚期NSCLC已提交sNDA,并获优先审评。此外,依达方®联合化疗对比替雷利珠单抗联合化疗一线治疗sq-NSCLC的III期临床研究,由合作伙伴Summit主导开展的依达方®联合化疗联合化疗用于经第三代EGFR-TKI治疗进展的EGFR突变、局晚期或转移性nsq-NSCLC的国际多中心III期临床研究(HARMONi研究)和依达方®联合化疗对比帕博利珠单抗联合化疗一线治疗sq-NSCLC的国际多中心III期研究正在进行中。依达方®正通过单药和联合用药在包括肺癌、胰腺癌、乳腺癌、肝细胞癌、结直肠癌等16个适应症领域布局。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57