多个临床试验叫停和死亡患者的出现让B7H3靶点蒙上了阴影。
·2019年1月,FDA叫停了CD3/B7H3双抗MGD009针对B7H3阳性实体瘤的临床I期试验,因为该临床出现了肝脏不良事件。
·2022年7月,B7H3单抗MGA271一项治疗复发难治性头颈鳞癌的II期临床试验被MacroGenic宣布停止,原因是该临床出现了11.3%的死亡事件。
·2024年5月,Macrogenics披露了在研核心产品B7H3 ADC新药Vobramitamab Duocarmazine(MGC-018)治疗前列腺癌II期临床TAMARACK的最新数据。数据中报告了5名患者死亡,以及≥50%的3级或以上的不良事件发生率。就在8月Macrogenics停止对B7H3 ADC药物MGC-018II期临床TAMARACK的继续给药(治疗转移性去势抵抗性前列腺癌)
以上结果的出现似乎说明B7H3这条路不好走,但是这并未浇灭企业的研发热情,仍有许多公司真努力攻克这一靶点,尤其是在ADC领域。
B7H3靶点
B7H3作为一种跨膜蛋白,和PD-L1(B7-H1)同属B7家族。在正常人体组织中,B7-H3表达水平较低,但在多种肿瘤中,如肺癌、前列腺癌、乳腺癌、头颈部鳞状细胞癌和食管鳞状细胞癌,B7-H3高表达。从而使B7H3成为抗肿瘤治疗领域的潜力靶点。
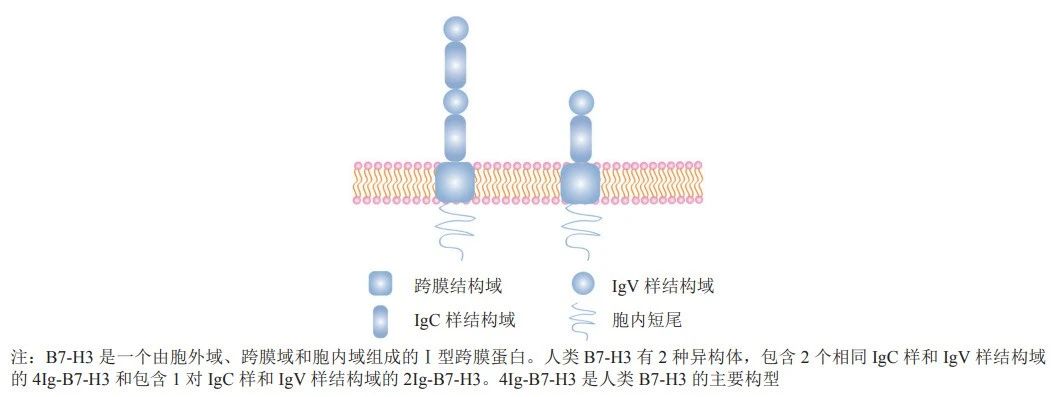
B7H3结构示意图
然而B7H3的成药之路并非一帆风顺,从单抗到双抗,均有药物折戟:
·2022年7月,B7H3单抗MGA271一项治疗复发难治性头颈鳞癌的II期临床试验被MacroGenic宣布停止,原因是该临床出现了11.3%的死亡事件。
·2019年1月,FDA叫停了CD3/B7H3双抗MGD009在B7H3阳性实体瘤中的I期临床试验,因为该临床试验出现了肝脏毒性
尽管多个药物研发失利,B7H3药物的研发仍然保持着高热度和稳定的需求。全球主要的制药公司对ADC寄予了厚望,并在这一领域进行了积极的投资和布局,2023年发生了多起BD交易:
·2023年4月3日,BioNTech公司以16.7亿美元的价格引进了映恩生物公司的两款ADC产品,DB-1311是其中一款针对B7H3的ADC。
·2023年10月19日,默沙东公司以220亿美元的价格引进了第一三共公司的三款ADC药物,其中包括针对B7H3的ADC药物ifinatamab deruxtecan。
·2023年12月20日,GSK公司以17.1亿美元的价格引进了翰森制药公司的B7H3 ADC药物HS-20093。
在研B7H3 ADC药物
·第一三共的DS-7300
DS-7300(I-DXd)是第一三共基于其DXd ADC技术平台开发的一款B7H3 ADC,DAR=4,是第一款进入3期临床的B7H3 ADC药物。
2024年7月11日,CDE官网公示,第一三共的DS-7300获批临床试验默示,适用于在含铂治疗期间或之后出现疾病进展的小细胞肺癌(SCLC)成人患者的单药治疗。
2023年9月,第一三共公布了I-DXd(6.4-16.0mg/kg)治疗接受过中位二线治疗的晚期SCLC患者的I/II期研究结果(NCT04145622)。结果显示,21例晚期SCLC患者经过治疗后,确认的ORR为52.4%,其中包括1例完全缓解(CR)和10例为部分缓解(PR);中位缓解持续时间(mDOR)为5.9个月,中位无进展生存期(mPFS)为5.6个月,mOS为12.2个月。
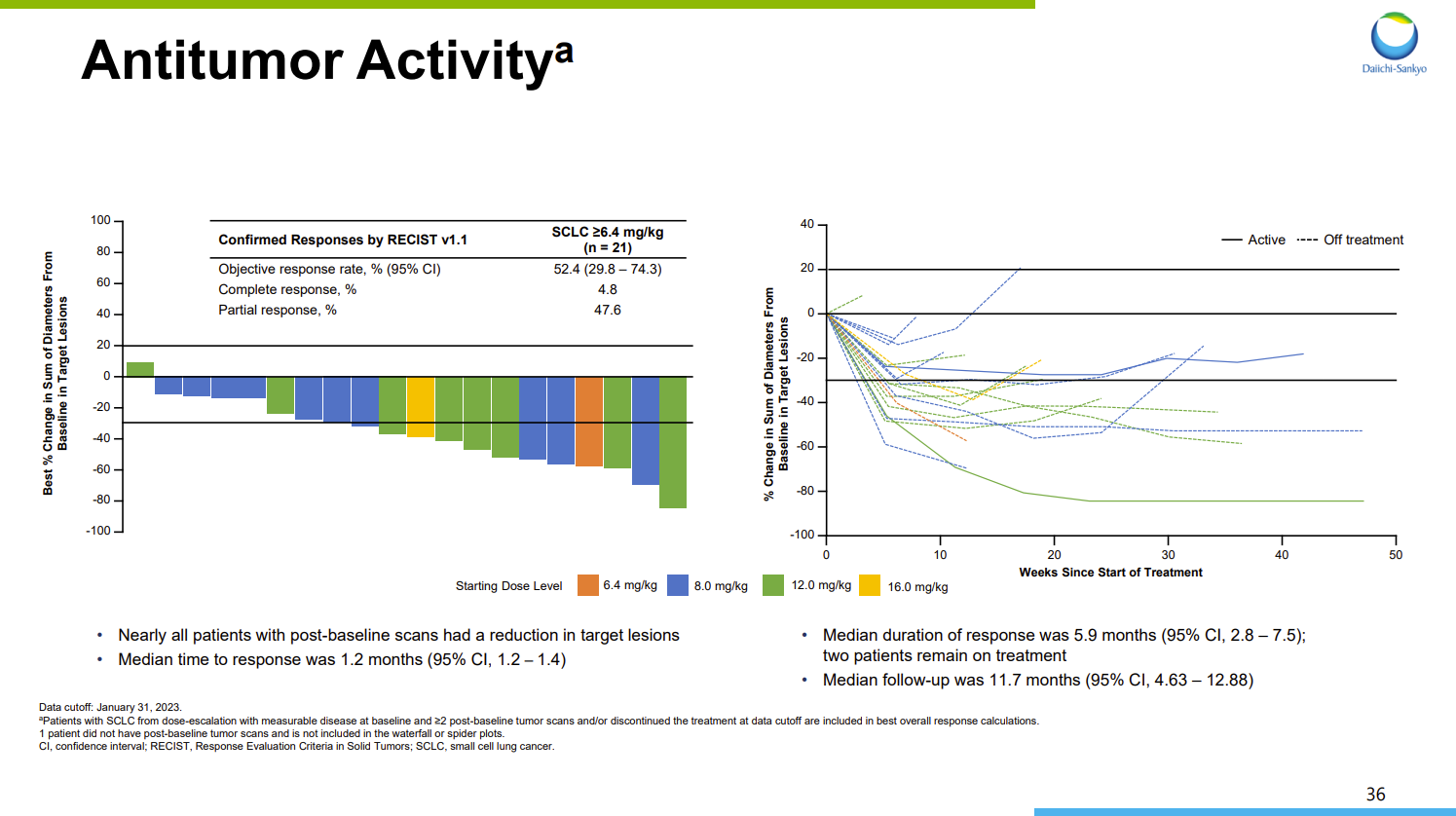
DS-7300抗肿瘤活性
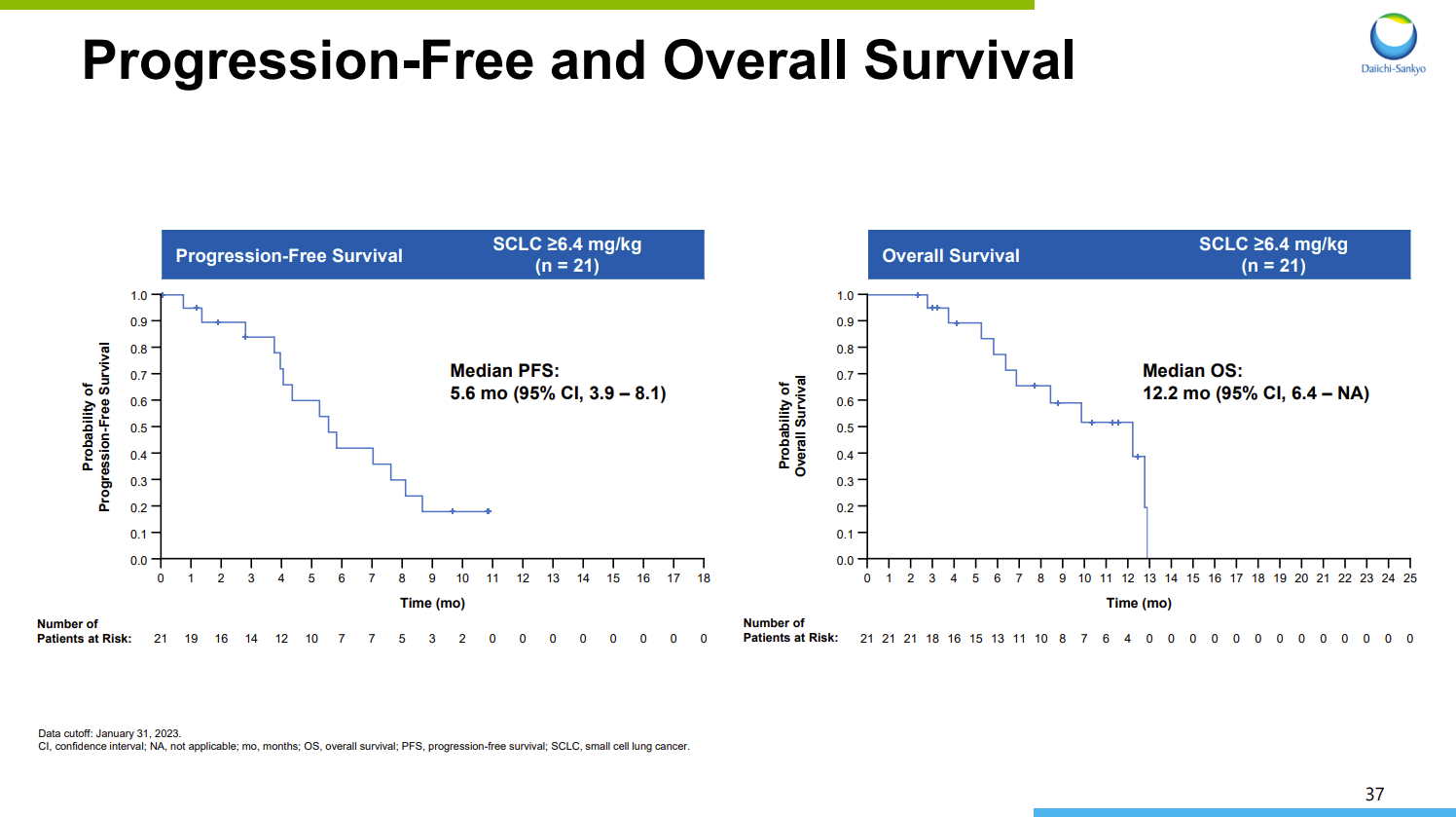
DS-7300的PFS和OS结果
·Macrogenics的MGC018
MGC018(vobra duo)是一款以人源化B7H3单抗为靶头、缬氨酸-瓜氨酸(vc)为可裂解连接子、前药seco-DUBA为载荷的ADC药物,DAR值约为2.7。

MGC018结构
说起来MGC018是一款具有“悲情色彩"的药物,早在其1期研究中,就因不良事件导致了高比例的剂量调整和治疗提前终止。86名患者中有78 名(91%)至少经历了一次任何级别的TRAE;有43名(50%) 经历了≥3级TRAE;以及两起死亡病例:一起原因不明,另一起由SARS-CoV-2引起。并且随着剂量的递增,不良事件发生率显著上升。
不过好在MGC018作为单药在治疗mCRPC患者时,显示出了不错的抗肿瘤活性。其(3mg/kg,Q3W)剂量组的ORR达25%。因此,Macrogenic也将3mg/kg定为2期临床的推荐剂量,不过,≥3级TRAE发生率依然不低(55.8%),并且出现了5例死亡事件,其中,2mg/kg剂量组出现1例急性心肌梗死(研究者认为与药物无关);2.7mg/kg剂量组聚集了最多的死亡人数,1例心脏骤停(研究者认为与药物无关),2例为肺炎,1例为胸腔积液导致的死亡。
近日,根据独立数据监测委员会的建议,Macrogenics停止对B7H3 ADC药物MGC-018II期临床TAMARACK的继续给药(治疗转移性去势抵抗性前列腺癌)。
·翰森生物/GSK的HS-20093
HS-20093(GSK5764227)是一种新型B7-H3靶向ADC,由全人源化的B7-H3单抗与拓扑异构酶抑制剂(TOPOi)有效载荷共价连接而成。
HS-20093最初由翰森制药开发,用于治疗肺癌、肉瘤、头颈癌和其他实体瘤,在中国开展多项1期和2期临床试验。
2023年12月,翰森制药与GSK达成1.85亿美元、里程碑费用15.25亿美元的独家许可协议,授予GSK全球独占许可(不含中国内地、香港、澳门及台湾),以开发、生产及商业化HS-20093。
2024年8月20日,翰森制药发布公告,其合作方GS申报的HS-20093(GSK5764227)获美国FDA突破性疗法认定。
在2024 ASCO年会上,披露了HS-20093在骨肉瘤和小细胞肺癌方面的治疗潜力。
·ARTEMIS-002研究:治疗复发/难治性骨肉瘤患者的2期试验,截止2023年12月25日,接受12.0 mg/kg HS-20093治疗的患者(共10例)ORR为20.0%;12.0mg/kg组的患者中观察到2例确认的部分缓解,长的缓解持续时间为4.0个月。接受8 mg/kg HS-20093治疗组的患者的疾病控制率为81.8%(9/11),接受12.0 mg/kg HS-20093治疗组的患者的疾病控制率为100%(10/10)。所有21名患者的中位无进展生存期尚未成熟。
·SCLC 患者扩展剂量部分的有效性和安全性结果:截止 2023 年 11 月 30 日,既往治疗中位数为 2.0(范围:1-6)。基线后扫描中,96.2% (50/52) 的患者出现目标病灶肿瘤缩小;44.2% (23/52) 的患者获得深度缓解,定义为肿瘤缩小≥50%;总体生存期中位数尚未达到;无论 B7-H3表达如何,在患者在都会观察到反应。药代动力学 (PK) 显示暴露量大约与剂量成比例增加,半衰期为 3-7 天。总抗体和 ADC 的 PK 曲线相似,且有效负载暴露量相当低。
·明慧医药的MHB088C
MHB088C是一款靶向B7H3的ADC,由人源化抗B7H3单克隆抗体与一种高效的DNA拓扑异构酶I抑制剂偶联而成。
在2024 ASCO披露了的1/2期研究,分为剂量递增(D-esc)和剂量扩展(D-exp)两个阶段。结果显示:截至2023年12月31日,在12名可评估反应的患者中,观察到5名部分缓解(PRs),ORR为41.7%;疾病控制率(DCR)为91.7%;在3名SCLC患者中,所有3名患者均达到PRs,即ORR为100.0%,其中1名达到完全缓解(CR),另1例患者的肿瘤体积减少近80%。2名SCLC患者的疗效是在1.6 mg/kg Q2W组中实现的。所有SCLC患者在第一次肿瘤评估中都出现缓解。
资料来源:



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57