今日(11月6日),根据中国国家药监局药品审评中心(CDE)官网公示,艾伯维CD3/CD20双抗艾可瑞妥单抗(Epcoritamab)注射用浓溶液上市申请获受理。
从药渡数据库检索可知,最早于2023年5月获FDA批准上市,适应症为接受过二线或多线系统治疗的复发或难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)患者;2024年6月, 艾可瑞妥单抗再获FDA批准新适应症:用于治疗至少接受过两种系统治疗的复发难治性滤泡性淋巴瘤(R/R FL)患者。自此艾可瑞妥单抗成为全球首个也是唯一一个同时能用于R/R FL和R/R DLBCL的双特异性抗体。
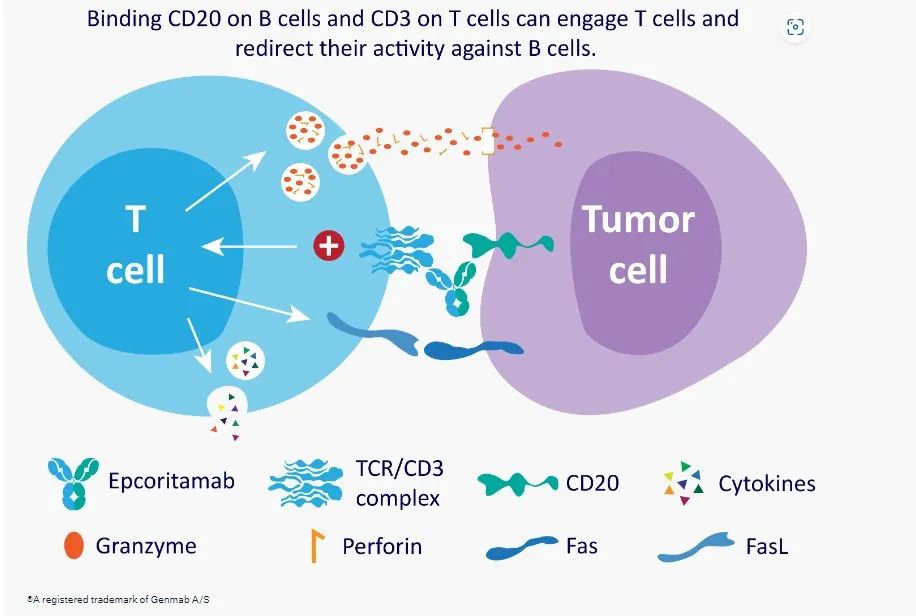
Epcoritamab可以同时结合B细胞上的CD20以及T细胞上的CD3,其作用机制是重定向T细胞并使其活化,在T细胞和B细胞之间形成免疫突触,导致穿孔素/颗粒酶B诱导肿瘤细胞凋亡。
Epcoritamab治疗R/R FL的2期临床研究结果于2024年6月在《Lancet Haematology》发表。关键队列共纳入128例患者,研究结果表明关键队列的总缓解率为82.0%(105/128),完全缓解率为62.5%(80/128);各预设亚组均获得缓解,包括高危亚组;关键队列中,首次缓解后18个月时,缓解患者中58.4%和完全缓解患者中72.2%保持缓解。治疗开始后18个月时,所有患者中49.4%和完全缓解患者中73.8%保持无进展生存。可评估患者中MRD阴性率为67%,MRD阴性患者的无进展生存率高于非阴性患者。在第3周期第1天可评估MRD的77例患者中,MRD阴性患者的无进展生存率也较高。18个月生存率为70.2%。
参考文献
1、CDE官网
2、药渡数据库
3、Epcoritamab monotherapy in patients with relapsed or refractory follicular lymphoma (EPCORE NHL-1): a phase 2 cohort of a single-arm, multicentre study.Lancet Haematol . 2024 Jun 13:S2352-3026(24)00166-2. doi: 10.1016/S2352-3026(24)00166-2.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57