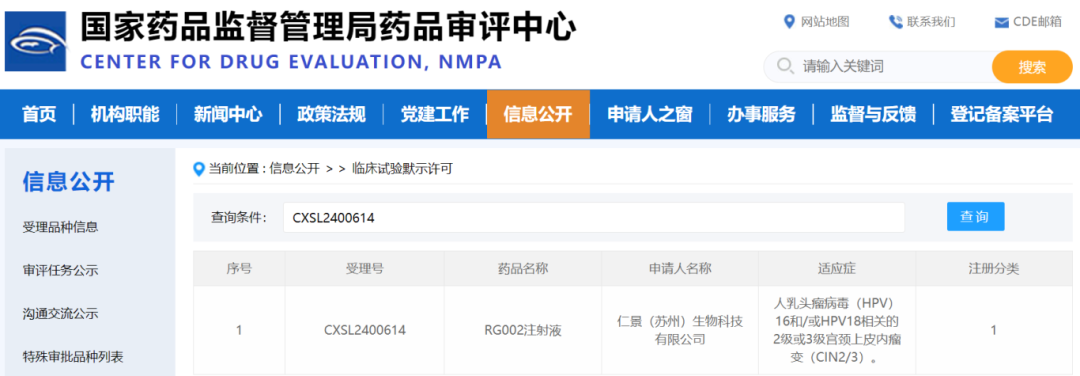
2024年12月4日,国家药品监督管理局药品审评中心(CDE)官网显示,仁景(苏州)生物科技有限公司(以下简称“仁景生物”)申报的1类新药RG002注射液获批临床,拟用于治疗人乳头瘤病毒(HPV)16和/或HPV18相关的2级或3级宫颈上皮内瘤变(CIN2/3)。
此前,RG002注射液已获FDA临床试验许可,是该适应症全球首个获得临床许可的mRNA产品。RG002中美接连获批进一步验证了仁景生物在抗原设计、递送载体、CMC等mRNA核心技术上的成熟性。仁景生物将加速RG002研发的全球进程。
RG002编码HPV16和18亚型的多个关键早期蛋白抗原,抗原设计不仅覆盖了临床上最重要的两个高危HPV型别,而且突破了单纯以E6/E7为抗原的传统设计理念。通过兼顾E6/E7驱动和非E6/E7驱动的肿瘤,为HPV16/18相关癌前病变和肿瘤治疗提供了潜在的更优解决方案。RG002采用仁景生物自主知识产权的mRNA序列和脂质纳米颗粒(LNP)递送系统,并基于抗原设计、序列优化和调控元件、制剂配方等多项专利技术进行整体优化。公司所采用的递送系统递送效率高、体内安全性优异。优异的临床前数据为RG002用于治疗HPV相关的持续感染、癌前病变和恶性肿瘤提供了坚实的基础。
关于仁景生物

仁景生物致力于开发基于mRNA技术的创新药物,以满足全球重大未满足的临床需求。其中,针对HPV16和18型病毒感染相关的治疗性产品已同时获得中美IND批准,另有多款产品如传染病疫苗处于IND阶段。公司具备mRNA药物和疫苗全链条自主研发及临床生产能力,拥有线状mRNA、环状RNA、LNP递送和CMC四大技术平台。2024年,仁景生物专利申请达到90余件,授权专利达10件。
资料来源:
1.仁景生物



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57