昨日(12月19日),Ionis Pharmaceuticals在官网宣布,公司开发的反义寡核苷酸(ASO)药物TRYNGOLZA™(Olezarsen)获FDA批准上市,每月给药一次,适应症:作为饮食辅助手段,用于降低家族性乳糜微粒血症综合征(FCS)成人患者的甘油三酯。FCS是一种罕见的遗传性严重高甘油三酯血症(sHTG),可能导致危及生命的急性胰腺炎(AP)。TRYNGOLZA™是首个获得 FDA 批准的治疗方法。

Olezarsen通过结合载脂蛋白C-III(ApoC-III)的信使RNA(mRNA)阻止其翻译,从而降低ApoC-III蛋白的生成。而载脂蛋白 C-III 是经过基因验证的降低甘油三酯的靶点,这一过程有助于减少甘油三酯的合成和释放,改善脂质代谢,降低心血管疾病的风险。
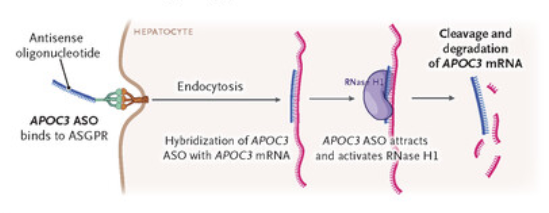
本次获批是基于一项全球多中心、随机、安慰剂对照、双盲III期Balance临床研究的积极数据,该试验针对基因鉴定为FCS且空腹甘油三酯水平≥880mg/dL的成年患者。在Balance研究中,Olezarsen治疗组80mg显示出统计学上显著的安慰剂调整后甘油三酯水平从基线到6个月平均降低 42.5%(p=0.0084)。从基线到12个月的降低程度进一步改善,实现了安慰剂调整后甘油三酯平均降低57%,Olezarsen治疗组还显示出12个月内AP事件显著减少,具有临床意义。Olezarsen安全性数据表明,最常见的不良反应(发生率>5%,频率较安慰剂组高>3%)是注射部位反应(19% vs 9%)、血小板计数减少(12% vs 4%)和关节痛(9% vs 0%)。
参考文献
1、Ionis Pharmaceuticals官网
2、Olezarsen for Hypertriglyceridemia in Patients at High Cardiovascular Risk



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57