12月25日,根据国家药品监督管理局药品审评中心(CDE)官网公示,勃林格殷格翰申报的HER2小分子抑制剂宗格替尼片(BI1810631,Zongertinib)拟纳入优先审批,适应症:治疗携带HER2(ERBB2)激活突变且既往接受过系统治疗的不可切除或转移性非小细胞肺癌(NSCLC)成人患者。
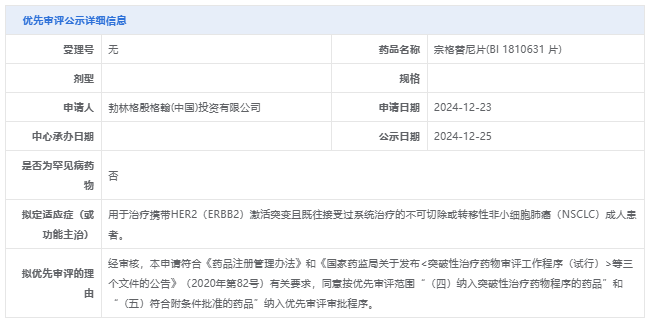
宗格替尼是一款新型HER2选择性酪氨酸激酶抑制剂,选择性结合HER2受体的酪氨酸激酶结构域(TKD),抑制野生型和突变型 HER2,包括ex20ins突变。避免了与抑制野生型EGFR相关的毒性。2023年,宗格替尼获得美国FDA快速通道资格;2024年,相继获得美国FDA及中国CDE的突破性疗法认定。
2024年ESMO亚洲大会上公布了BEAMION LUNG-1试验Ib期队列1的最新研究数据,研究旨在评估评估Zongertinib(BI1810631)在治疗携带人表皮生长因子受体-2(HER2)突变阳性晚期非小细胞肺癌(NSCLC)经治患者中的疗效。研究纳入132名患者接受了每日120mg或240mg的Zongertinib治疗(n=75/n=57),研究结果表明:经中心审查确认,Zongertinib(剂量为每日120mg,单次服用,n=75例患者):客观缓解率(ORR)为71%,疾病控制率(DCR)高达93%。6个月无进展生存期(PFS)和缓解持续时间(DoR)比例分别为69%和73%。全球性III期临床试验Beamion LUNG-2,正在评估Zongertinib相对于标准治疗作为晚期HER2突变阳性NSCLC患者一线治疗的效果,该试验目前正在患者招募进行中。
参考文献
1、CDE官网
2、勃林格殷格翰中国官网



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57