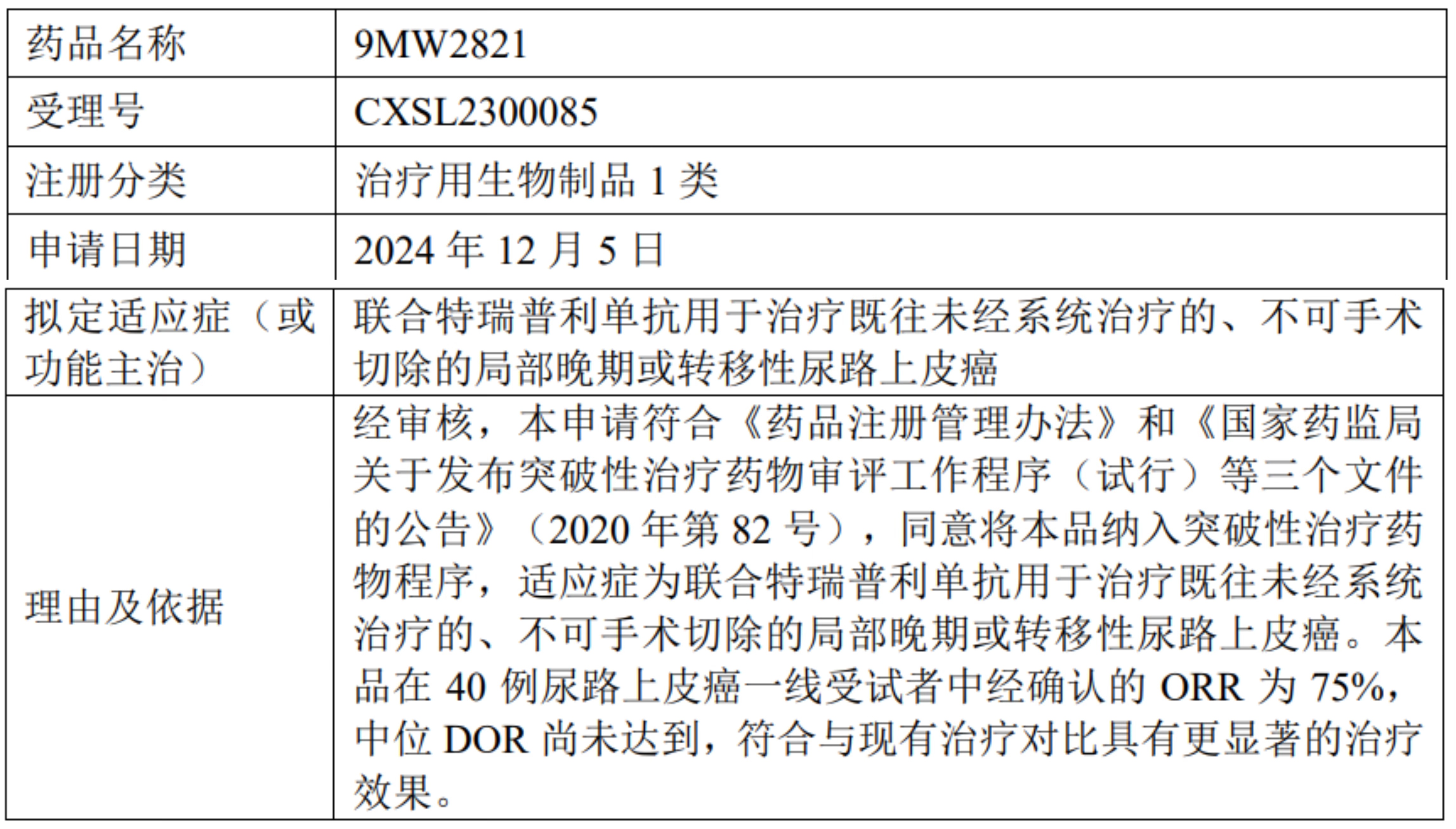
迈威(上海)生物科技股份有限公司(以下简称“迈威生物”或“公司”)采用自主知识产权研发的创新药 9MW2821 目前针对尿路上皮癌、宫颈癌、食管癌、乳腺癌等多个适应症正在开展多项临床研究。近日,9MW2821 被国家药品监督管理局药品审评中心(以下简称“药审中心”)纳入突破性治疗品种公示名单,适应症为联合特瑞普利单抗用于治疗既往未经系统治疗的、不可手术切除的局部晚期或转移性尿路上皮癌。
截至目前,40 例尿路上皮癌一线可肿评受试者中,ORR 为 87.5%,经确认的 ORR 为 80%,疾病控制率(DCR)为 92.5%。中位无进展生存期(PFS)和缓解持续时间(DOR)尚未达到。
此事项尚处于公示阶段,公示期为 2025 年 1 月 8 日至 2025 年 1 月 15 日。现将相关情况公告如下:
二、药品其他相关情况
9MW2821 为迈威生物靶向 Nectin-4 的定点偶联 ADC 新药,为公司利用 ADC 药物开发平台开发的创新品种,通过具有自主知识产权的偶联技术连接子及优化的 ADC 偶联工艺,实现抗体的定点修饰。9MW2821 注射入体内后,可与肿瘤细胞表面的 Nectin-4 结合并进入细胞,通过酶解作用,定向释放细胞毒素,从而实现对肿瘤的精准杀伤。公司目前正在针对尿路上皮癌、宫颈癌、食管癌、乳腺癌等多个适应症开展多项临床研究。针对尿路上皮癌( UC ) , 9MW2821 有多项临床研究同步开展。
9MW2821-2023-CP104 临床试验中,共有 40 名既往未经治疗的局部晚期或转移性尿路上皮癌(la/mUC)患者被纳入研究,接受 9MW2821(剂量为1.25mg/kg)与特瑞普利单抗(Toripalimab,240mg)的联合治疗。截至目前,客观缓解率(ORR)为 87.5% [35/40,95% CI73.2-95.8],经确认的 ORR 为80%。疾病控制率(DCR)为 92.5% [37/40,95% CI79.6-98.4]。中位无进展生存期(PFS)和缓解持续时间(DoR)尚未达到。本研究中尚未观察到新的 9MW2821 或特瑞普利单抗的安全信号。
近日,9MW2821 被药审中心纳入突破性治疗品种公示名单,适应症为联合特瑞普利单抗用于治疗既往未经系统治疗的、不可手术切除的局部晚期或转移性尿路上皮癌,目前尚处于公示阶段。根据《国家药监局关于发布<突破性治疗药物审评工作程序(试行)>等三个文件的公告》(2020 年第 82 号),为鼓励研究和创制具有明显临床优势的药物,药审中心对纳入突破性治疗药物程序的药物优先配置资源进行沟通交流,加强指导并促进药物研发;并且,经评估符合相关条件的,也可以在申请药品上市许可时提出附条件批准申请和优先审评审批申请。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57