今日(1月9日),赛诺菲在其官网宣布,血液肿瘤新药CD38单抗艾沙妥昔单抗(Isatuximab,商品名赛可益)国内获批上市。获批适应症为用于与泊马度胺和地塞米松联合用药,治疗既往接受过至少一线治疗(包括来那度胺和蛋白酶体抑制剂)的多发性骨髓瘤成人患者。艾沙妥昔单抗最早于2020年3月在美国获FDA批准。
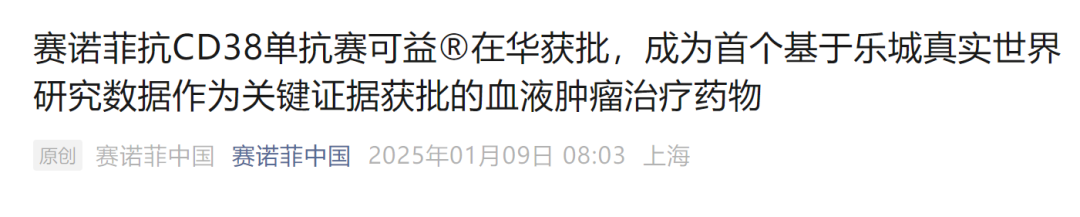
本次获批是基于全球III期ICARIA-MM研究结果以及中国lsaFiRsT真实世界研究结果。ICARIA-MM是一项随机、双盲、安慰剂对照的全球III期临床研究,旨在评估艾沙妥昔单抗联用泊马度胺和地塞米松(isa-Pd治疗组)对比Pd治疗组,在既往接受过至少一线治疗(包括来那度胺和蛋白酶体抑制剂)的多发性骨髓瘤患者的疗效和安全性。研究结果表明:艾沙妥昔单抗治疗组和Pd治疗组中位PFS分别为11.5个月和6.5个月,联用疗法可显著降低40%疾病进展或死亡风险,延长PFS近两倍。随访52.4个月的中位OS分别为24.6个月和17.7个月,联用治疗组延长患者中位OS为6.9个月。
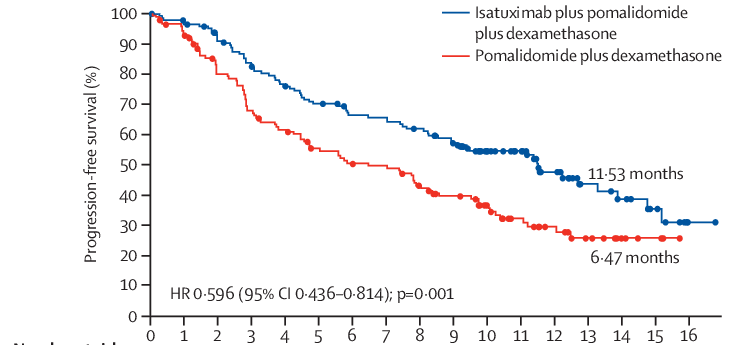
IsaFiRsT真实世界研究2024年EHA上首次公布,该研究为一项单臂、观察性、前瞻性研究,共纳入了24例患者截至2023年11月12日与全球III期ICARIA-MM研究结果一致Isa-Pd联合疗法对中国复发或难治性多发性骨髓瘤患者的总体缓解率达到82.6%,至首次缓解的中位时间为1.18个月(范围为0.9-3.1个月)。
参考文献
1、赛诺菲官网
2、Isatuximab plus pomalidomide and low-dose dexamethasone versus pomalidomide and low-dose dexamethasone in patients with relapsed and refractory multiple myeloma (ICARIA-MM): a randomised, multicentre, open-label, phase 3 study
3、2024EHA



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57