1月20日,从国家药品监督管理局药品审批中心(CDE)公示可知,百济深圳申报的BG-60366片获批临床试验默示许可,适应症为EGFR突变型非小细胞肺癌。
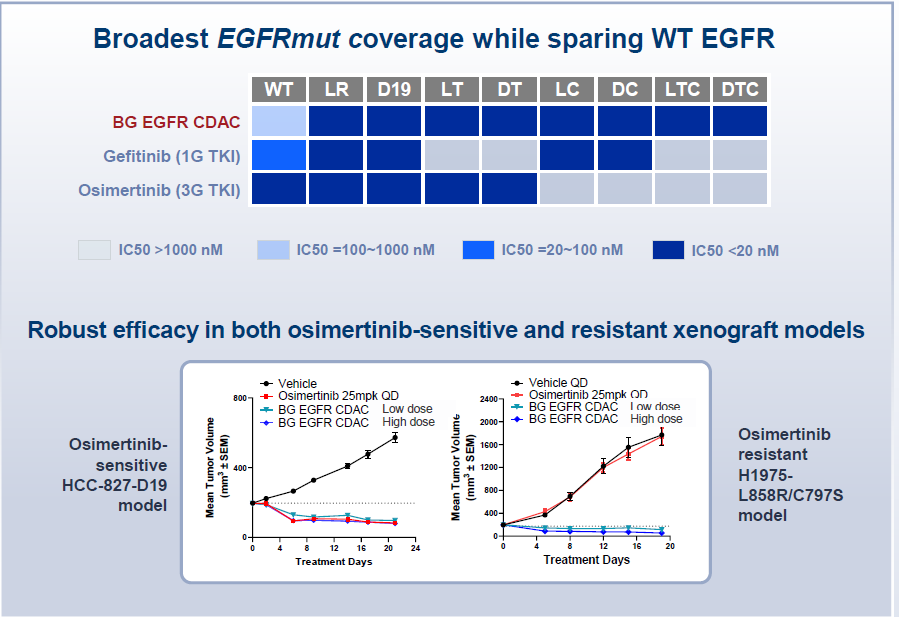
BG-60366是百济神州基于CDAC平台开发的一款新型EGFR降解剂(EGFR CDAC),对 EGFR 突变具有高效性,同时保留野生型EGFR,具有良好的安全性。可广泛覆盖多种EGFR突变,对奥希替尼敏感和耐药的EGFR突变临床前模型中均有显著的抑瘤作用。2024年11月12日,百济神州在Clinicaltrials.gov网站上已注册了BG-60366的临床I期试验,未来销售峰值有望超40亿美元。
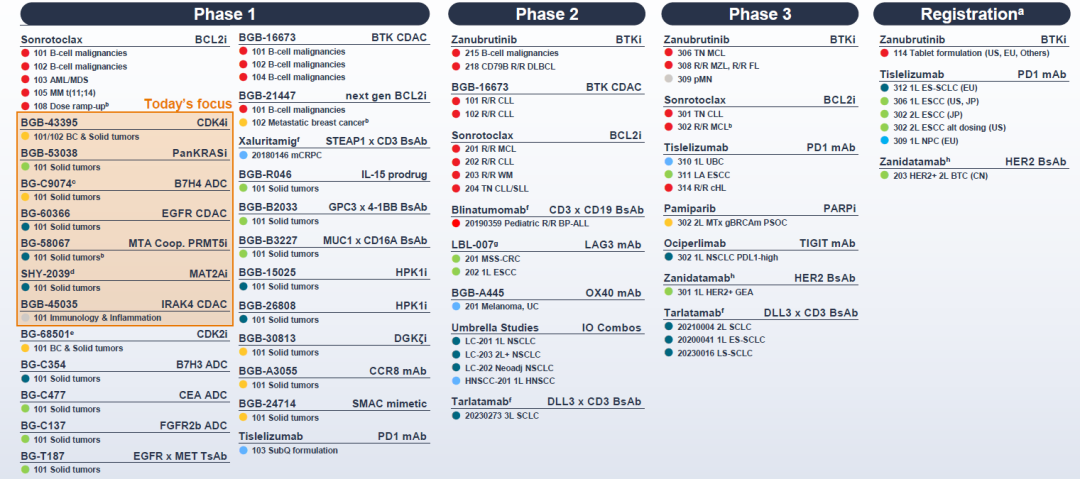
从百济神州2025JPM公布的最新管线信息,目前已有多款CDAC药物进入临床阶段,BGB-45035(IRAK4 CDAC)用于治疗中重度特应性皮炎,目前已招募了90多名受试者;SAD和MAD预计将于2025年上半年完成,该药物在人体中半衰期较长,并且在第一个MAD剂量水平(5mg)下观察到血液中完全的IRAK4降解,预计于2025年进入临床II期。
BGB-16673(BTK CDAC)在2024年ASH年会上更新了治疗CLL/SLL临床I期数据。研究结果表明,在49例反应可评估的患者中,ORR(部分反应伴淋巴细胞增多或更好)为78%(38/49),血液学恢复率不完全的CR/CR为4%(n=2)。在200mg时,ORR为94%(15/16),包括2个CRs。首次反应的中位时间为2.8个月 (范围:2.6-8.3个月)。17例患者持续治疗9个月,所有17例患者均有持续反应。
参考文献
1.CDE官网
2.百济神州官网
3.2024ASH



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57