海思科医药集团股份有限公司(以下简称“公司”) 于近日收到国家药品监督管理局下发的《药物临床试验批准通知书》,现将相关情况公告如下:
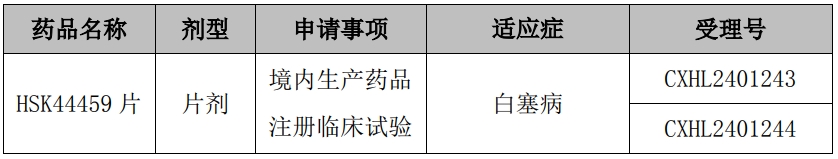
根据《中华人民共和国药品管理法》及有关规定,经审查,2024 年 11 月受理的 HSK44459 片临床试验申请符合药品注册的有关要求,同意本品开展临床试验。
一、 研发项目简介
贝赫切特病又称白塞病(Behcet’s disease),是一种以血管炎为基础病理改变的慢性、复发性自身免疫/炎症性疾病,主要表现为反复发作的口腔溃疡、生殖器溃疡、葡萄膜炎和皮肤损害,亦可累及周围血管、心脏、神经系统、胃肠道、关节、肺、肾等器官,被列入 2023 年中国第二批罕见病名录。白塞病目前尚无公认的有效根治药物,主要治疗目的是迅速抑制炎症,阿普斯特是目前唯一获批用于白塞病治疗的 PDE4 抑制剂,但不良反应明显。基于白塞病的临床现状,有效性和安全性更好的治疗药物仍有较大的临床需求。
HSK44459片是我公司自主研发的一个全新的具有独立知识产权的治疗白塞病的药物。临床前研究结果表明,本品靶点明确、疗效确切、安全性好,是一款极具开发潜力的小分子药物,临床应用的效益/风险比高,具有广阔的临床应用前景,有望成为白塞病的有效治疗药物并解决目前临床用药匮乏的难题。根据国家药品监督管理局关于发布《化学药品注册分类及申报资料要求》的通告(2020年第44号)中化学药品注册分类的规定,本品属于化学药品1类。
HSK44459于2024年8月获得“间质性肺疾病”适应症的临床试验批准通知书(公告编号:2024-072),目前已完成Ⅰ期临床研究。本次获得批准的适应症为白塞病。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57