2025 年 1 月 28 日,FDA 批准 Enhertu 用于治疗 HER2 微量表达的晚期乳腺癌,该药通过三重智能设计提升疗效,显著改善患者生存与生活质量,未来还有多种发展方向。
2025年1月28日,第一三共(Daiichi Sankyo)与阿斯利康(AstraZeneca)共同宣布,FDA最新批准抗癌药Enhertu用于治疗HER2微量表达的晚期乳腺癌,这类患者约占所有乳腺癌的85%,此前被归为「无靶向药可用」群体。该药将疾病进展时间从8个月延长至13个月,有效率提升近一倍。
过去将HER2蛋白表达简单分为「阳性」(适合靶向药)和「阴性」(只能化疗)。实际上:
-
HER2低表达:细胞表面有少量HER2蛋白(类似手机信号1格)
-
HER2超低表达:仅个别细胞有微弱HER2(类似时有时无的WiFi信号)
颠覆性发现:
Enhertu的临床试验证明,即使HER2表达量仅为传统阳性标准的1/100,药物仍能精准锁定癌细胞。
二、药物工作原理:三重智能设计
-
识别能力比传统药物强50倍,可捕捉到单个癌细胞表面的3-5个HER2蛋白
-
类比:普通导 弹需要锁定大型建筑,而Enhertu能锁定一辆汽车
-
-
技术突破:载药量是同类药物的2.3倍,每个抗体携带8个化疗弹头
-
被摧毁的癌细胞会释放药物,杀伤周围10-15个癌细胞
-
效果类比:在人群中引爆一枚智能炸弹,仅传染给癌细胞
三、关键临床数据解读
1. 生存时间突破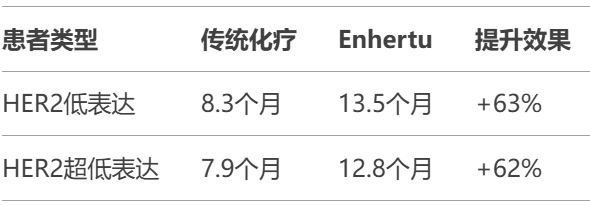
-
用药组62.6%患者肿瘤显著缩小,对照组仅34.4%
-
-
主要风险:3.5%患者出现肺部炎症(需定期CT检查)
-
四、治疗流程革新
-
确诊晚期乳腺癌 → 2. 检测HER2微量表达 → 3. 内分泌治疗失败后首选Enhertu
-
-
病理报告需注明:HER2 0(有膜染色)/1+/2+
五、对患者的现实意义
-
美国年治疗费约18万美元,国内上市后预计40-60万元/年
-
可申请药厂援助计划(年自付部分可降至10-15万元)
六、未来展望
1. 治疗前移:2025年或拓展至术后辅助治疗
2. 联合用药:与免疫疗法联用试验已启动
3. 剂型创新:皮下注射剂型正在研发,未来可居家给药
[1] Enhertu approved in the US as first HER2-directed therapy for patients with HER2-low or HER2-ultralow metastatic breast cancer following disease progression after one or more endocrine therapies. Retrieved January 27, 2025 from https://www.astrazeneca.com/media-centre/press-releases/2025/enhertu-approved-in-us-for-breast-cancer-post-et.html




![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57