2024年2月14日,石药集团在CDE药物临床试验登记与信息公示平台网站上,登记了一项ROR1 ADC药物SYS6005,在多种晚期恶性肿瘤中患者中,启动I期临床试验CTR20250511,悄然之间,石药进入临床的自主开发ADC药物来到了8款。
石药ROR1 ADC药物SYS6005登记信息
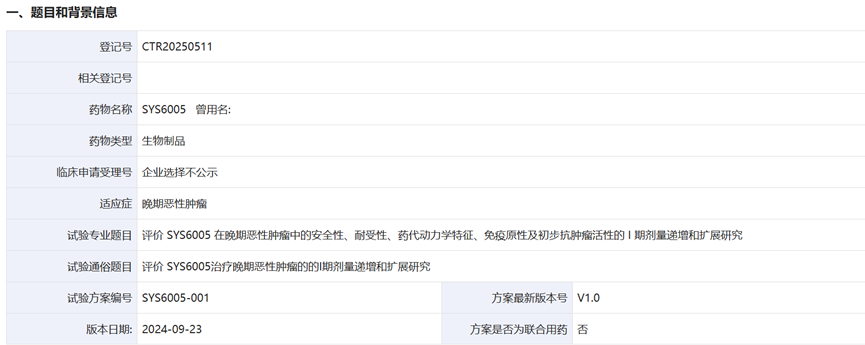
来源:CDE药物临床试验登记与信息公示平台
石药集团作为国内传统药企,近年来在新技术上进行了广泛积极布局,例如在mRNA领域并不算首批研发企业,但基于其深厚的复杂制剂研发经验,上演了后来居上的案例,成功开发了中国首 款mRNA疫苗上市产品。
在ADC领域,石药集团的涉足同样并不算最早,首 款ADC药物DP303c在2019年10月进入临床,根据当前公开信息显示,石药集团通过内部研发或合作,目前有10款产品已经获得临床试验批准,并且多款已经推入III期阶段,两款产品实现了海外授权,同时还有多款处于临床前,大有如mRNA领域中厚积薄发的潜力,本文简要梳理石药集团的ADC药物研发管线。
石药集团ADC药物管线
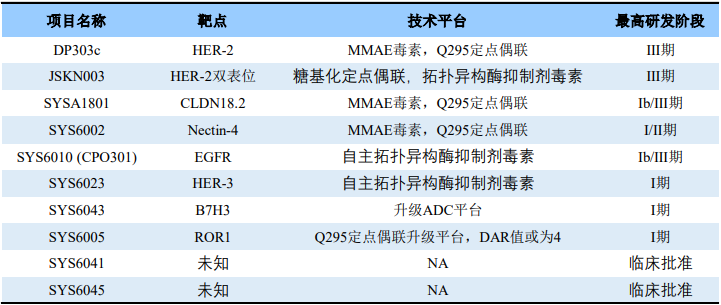
来源:CDE
1
DP303c
DP303c石药集团首个开发的ADC产品,以HER2为靶点,于2019年7月获国家药监局批准临床,目前最快的临床已进入两项III期临床研发,同时还有多个单药及联合治疗临床同时正在开展。
DP303c作为下一代HER2 ADC,抗体部分同样采用曲妥珠单抗,毒素采用MMAE,连接子在VC的基础上稍加改进,采用了Q295的定点偶联,DAR值为2。
DP303c结构
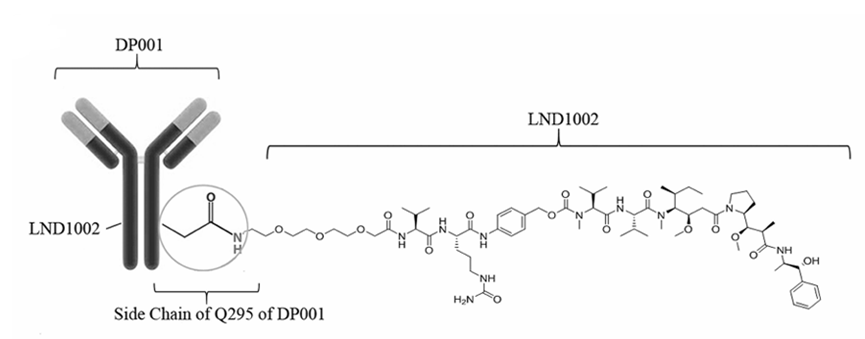
来源:OncoTargets and Therapy 2022: 15 331–343
2024年公布的I期临床结果显示,截至2023年2月28日,中位随访时间为12.0个月。在91例可评估疗效的患者中,39例患者达到客观反应,包括32例确诊反应和7例未确认反应。
在66例疗效可评估的乳腺癌患者中,34例患者 (51.5%)达到客观反应,51例患者(77.3%)得到控制,所有乳腺癌患者的中位PFS为6.4个月。
在结直肠癌和胃癌亚组的分析中,ORR分别为10.0%和25.0%,DCR分别为30.0%和50.0%,此外在唾液腺癌患者和小肠癌患者中,也各观察到一例响应。
DP303c I期临床试验结果
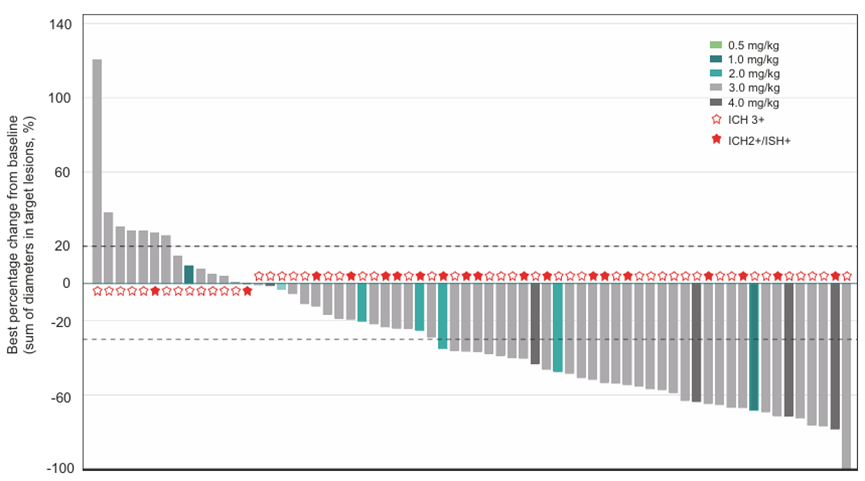
来源:Precision Oncology (2024) 8: 200
在首次以1.0至4.0mg/kg的剂量施用DP303c后,DP303c和总抗体在药代动力学特征上表现出相似性,其特征是相似的暴露水平、较长的半衰期和低清除率。在3.0mg/kg的剂量水平下,DP303c和总抗体的半衰期分别为2.98天和2.81天,一定程度体现了定点偶联技术的稳定性,将3.0mg/kg Q3W被确定为推荐的II期剂量。
目前DP303c正在进行,对比曲妥珠单抗联合长春瑞滨/卡培他滨三线及以上治疗HER2阳性晚期乳腺癌、以及对比恩美曲妥珠单抗在晚期乳腺癌中两项关键III期头对头临床试验,同时还在卵巢癌中进行探索。
2
JSKN003
目前石药集团另外一款处于III期的ADC药物JSKN003同样靶向HER2 ,但是抗体母体为HER2双表位抗体,同时毒素采用拓扑异构酶抑制剂。2024年9月30日,石药集团以最高共计30.8亿元人民币的首付款和里程碑付款,加净销售额两位数百分比的特许权使用费的形式,从康宁杰瑞获得JSKN003在中国内地的商业化权利。
JSKN003是由康宁杰瑞开发的HER2双表位ADC,抗体部分是共轻链结构,重链则由已上市的HER2单抗曲妥珠单抗、帕妥珠单抗组成,靶向HER2胞外区的ECD2和ECD4两个表位,连接子为可切割Dibenzocyclooctyne tetrapeptide,毒素为TOP I抑制剂,通过糖基定点偶联,DAR值约为4。
JSKN003结构
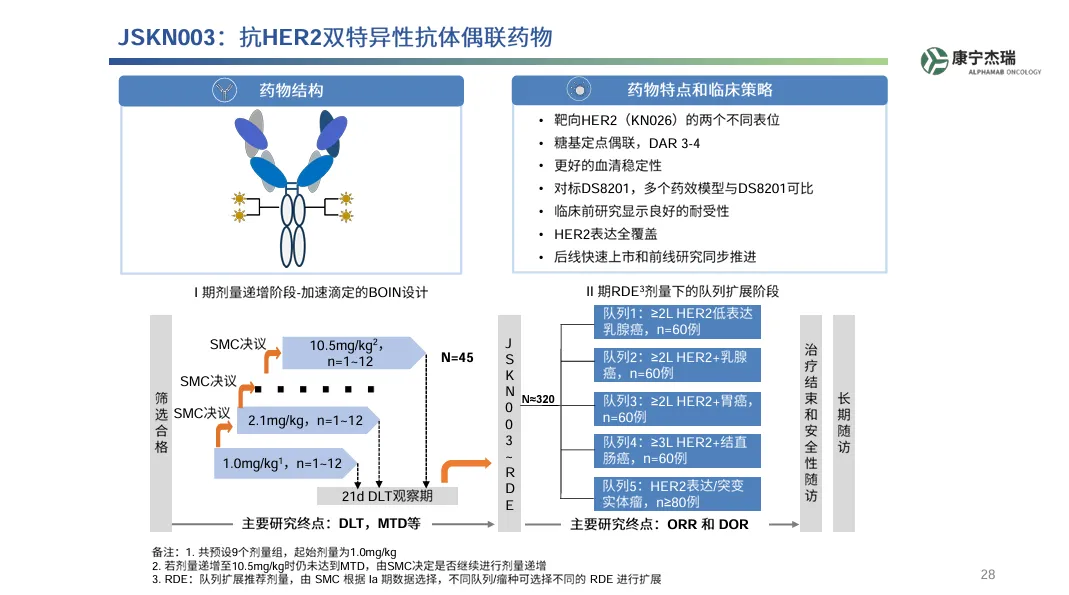
来源:康宁杰瑞官网
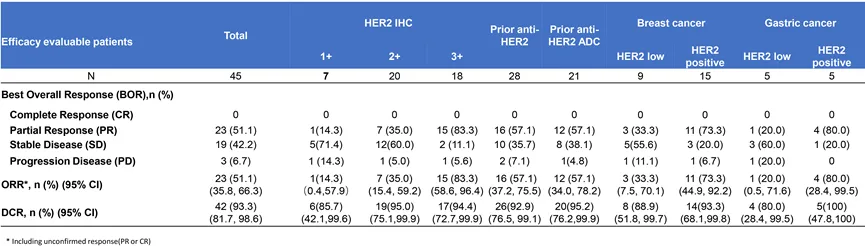
2024年ASCO期间公布中国I期临床数据显示,45例患者可进行总体有效性分析,ORR为51.1%(23/45),DCR为93.3%。IHC 1+、2+和3+患者的ORR分别为14.3%(1/7)、35.0%(7/20)和83.3%(15/20),最高剂量爬升至8.4 mg/kg。
其中,既往接受过抗HER2治疗的患者ORR达到了57.1%(16/28),21例既往接受过抗HER2 ADC治疗的患者ORR达到了57.1%(12/21)。
JSKN003中国I期临床结果
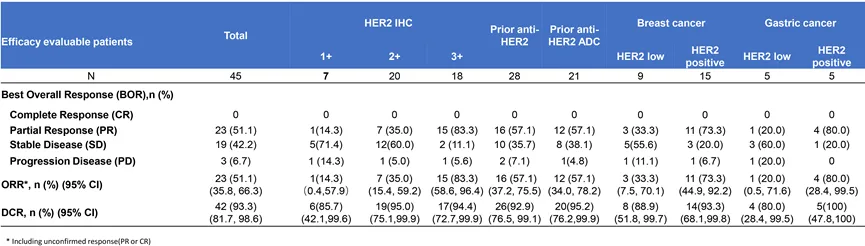
来源:康宁杰瑞官网
在HER2阳性患者中,15例乳腺癌患者的ORR为73.3%,5例胃癌患者的ORR为80%;在HER2低表达患者中,9例乳腺癌患者的ORR为33.3%,5例胃癌患者的ORR为20%。
中位治疗时间为19.2周(约4.5个月),3级TRAEs发生率仅为19.6%(9/46 pts),无3级以上TRAEs。3例(6.5%)患者发生治疗相关严重不良事件(SAEs),1例为3级恶心,2例为2级间质性肺炎,未发生剂量限制性毒性(DLT)事件,无TRAE导致终止治疗。
JSKN003中国I期临床结果
来源:康宁杰瑞官网
JSKN003目前正在进行两项III期临床,其也是全球首个启动III期临床的双抗ADC药物。2023年率先启动了治疗HER2低表达的、一线或二线治疗失败的复发或转移性乳腺癌III期临床,2025年2月刚刚启动对比恩美曲妥珠单抗(T-DM1)治疗HER2阳性晚期乳腺癌的III期临床研究,未来值得期待。
再次回到石药集团的自主研发管线,成功开发了DP303c后,基于Q295的定点偶联技术平台,石药集团继续开发了CLDN18.2 ADC药物SYSA1801和Nectin-4 ADC药物SYS6002,并且两者都实现了海外授权。
3
SYSA1801
SYSA1801是石药集团开发的第二款ADC产品。2022年7月28日,石药集团宣布将Claudin18.2 ADC新药SYSA1801的大中华区外全球权益授权给Elevation Oncology,后者支付2700万美元预付款+1.48亿美元开发及监管里程碑金额+10.2亿美元销售里程碑金额,以及最高双位数比例的销售分成。
SYSA1801(EO-3021)在多个方面进行了差异化的设计,抗体方面对CLDN18.2具有高度选择性,不结合CLDN18.1,Fc端保持完整的CDC/ADCC功能,同时采用MMAE作为payload,酶裂解工艺,Q295的定点偶联,DAR值为2。
SYSA1801(EO-3021)结构

来源:Elevation Oncology官网
2023年ASCO期间,EO-3021/SYSA1801公布了其在中国进行的I期临床数据,17例可评估的胃癌患者中,客观响应率达到47.1%,疾病控制率达到64.7%。
SYSA1801中国I期临床结果
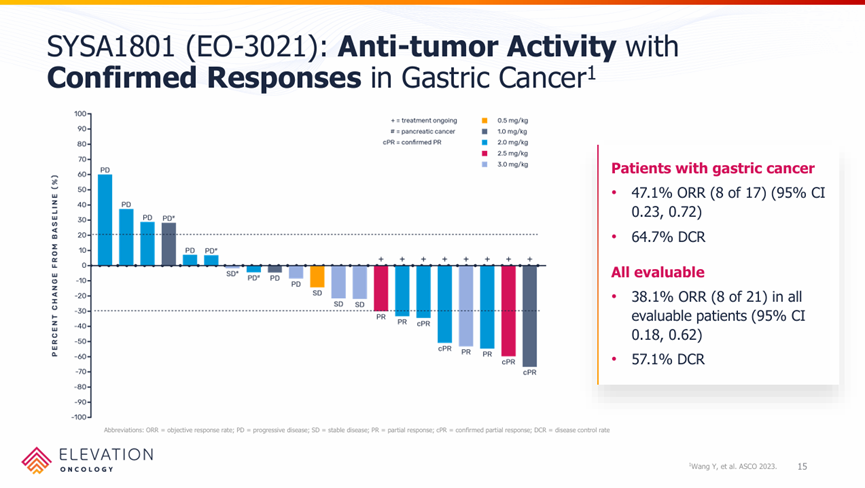
来源:Elevation Oncology官网
来到美国临床,Elevation Oncology对EO-3021/SYSA1801的临床设计更为激进,起始剂量从0.5mg/kg提升到1mg/kg,同时对入组患者的CLDN18.2表达量不做要求,而此前中国患者的CLDN18.2表达量严格控制在>1%。
就是这一激进设计几乎让Elevation Oncology陷入绝境,2024年8月6日,Elevation oncology公布EO-3021在美国开展I期临床结果,15位可评估患者中的响应率仅为20%,还包括一例未确认PR,远低于此前中国I期临床的47%响应率,基于此消息Elevation oncology股价暴跌63%。
但将美国临床中的CLDN18.2表达量>20%的七位患者进行分层分析,其响应率和疾病控制率分别为42.8%和71.4%,和此前中国临床的数据基本一致,仍然还有机会,>20%也和其它几款CLDN18.2 ADC入组的表达量要求类似。
EO-3021/SYSA1801美国I期临床结果
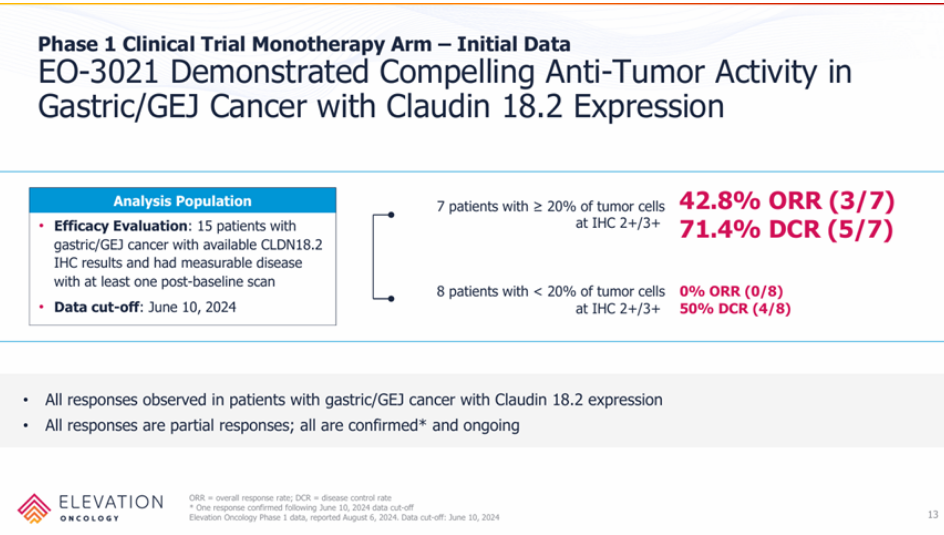
来源:Elevation Oncology官网
特别是通过药代动力学的分析,相较于传统的VC-MMAE ADC,EO-3021/SYSA1801具有更高的总ADC和血浆游离MMAE暴露量,一定程度显示了Q295定点偶联技术的优势。
EO-3021/SYSA1801美国I期临床结果
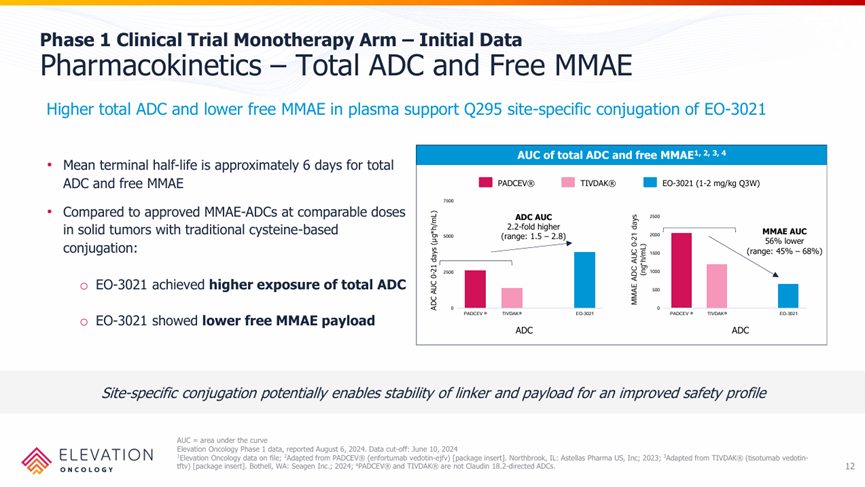
来源:Elevation Oncology官网
同时在安全性方面,和其它CLDN18.2 ADC比较,EO-3021/SYSA1801也显示出更低的毒素相关毒性,进一步凸显其结构差异化设计的优势。
EO-3021/SYSA1801美国I期临床结果

来源:Elevation Oncology官网
目前EO-3021/SYSA1801在中美采用了差异性的临床推进策略,中国正在进行一项联合卡培他滨对比奥沙利铂联合卡培他滨一线治疗CLDN18.2阳性、PD-L1 CPS<5的Ib/III期研究,在美国则分别和二线VEGFR抗体Ramucirumab、以及一线PD-1抗体dostarlimab的联合治疗临床试验,并将CLDN18.2表达量限定在25%以上,期待相关临床早日传来临床捷报。
4
SYS6002
SYS6002是石药集团开发的第三款ADC产品,2023年2月13日,石药集团与Corbus Pharmaceuticals订立独家授权协议,将Nectin-4 ADC在海外多个地区的开发及商业化授权给Corbus,后者将支付750万美元预付款,以及1.3亿美元的潜在开发及监管里程碑付款,以及最多5.55亿美元的潜在销售里程碑付款 ,以及一定比例的销售分成。合同总金额高达6.925亿美元。
SYS6002(CRB-701)也在多个方面进行了差异化的设计,Fc端保持完整的CDC/ADCC功能,同时采用MMAE作为payload,酶裂解工艺,Q295的定点偶联,DAR值为2。
SYS6002(CRB-701)结构
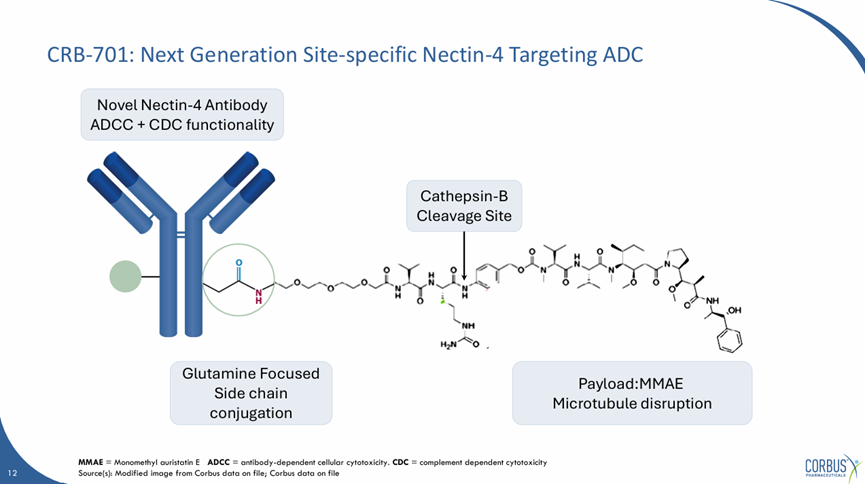
来源:Corbus官网
2024年ASCO会议期间,石药集团首次公布了SYS6002在中国进行的I期临床数据,整体人群中取得了28%的客观响应率,68%的疾病控制率。在尿路上皮癌中取得了44%的客观响应率,78%的疾病控制率;在宫颈癌中取得了43%的客观响应率,86%的疾病控制率。
SYS6002(CRB-701)中国I期临床结果
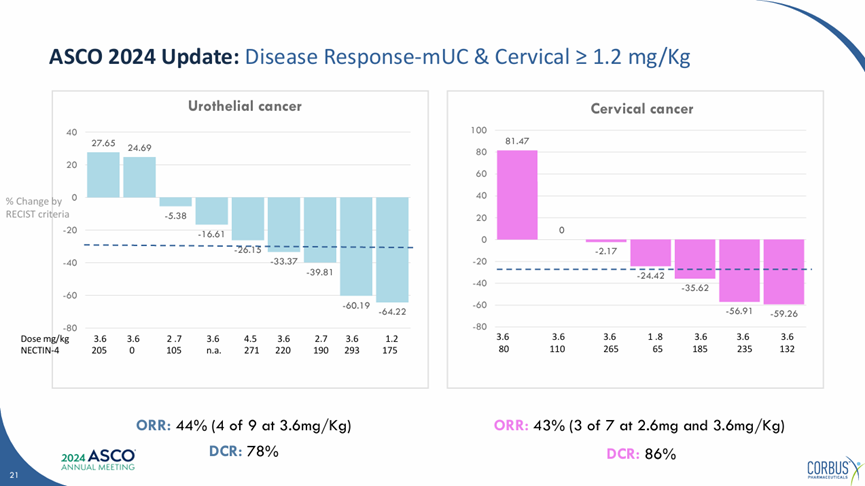
来源:Corbus官网
2024年2月14日,2025 ASCO GU会议上,石药合作伙伴Courbus首次公布了SYS6002在美国进行的I期临床数据,整体人群中取得了27%的客观响应率,77%的疾病控制率,于中国人群高度一致。
在特定适应症中有部分差异,美国临床尿路上皮癌中取得了25%的客观响应率,50%的疾病控制率;在宫颈癌中取得了50%的客观响应率,50%的疾病控制率。
SYS6002(CRB-701)美国I期临床结果
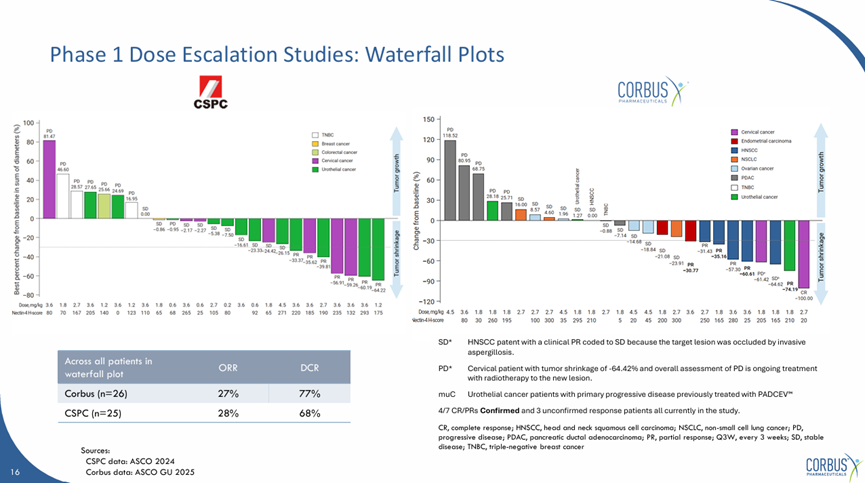
来源:Corbus官网
但是在头颈鳞癌中,美国临床中取得了较大突破,取得了57.1%的客观响应率,高于Seagen Nectin-4 ADC药物PADCEV 23.9%的数据,也高于PD-1抗体Keytruda 18%的数据,有望成为其差异化开发的突破口。
SYS6002(CRB-701)美国I期临床结果
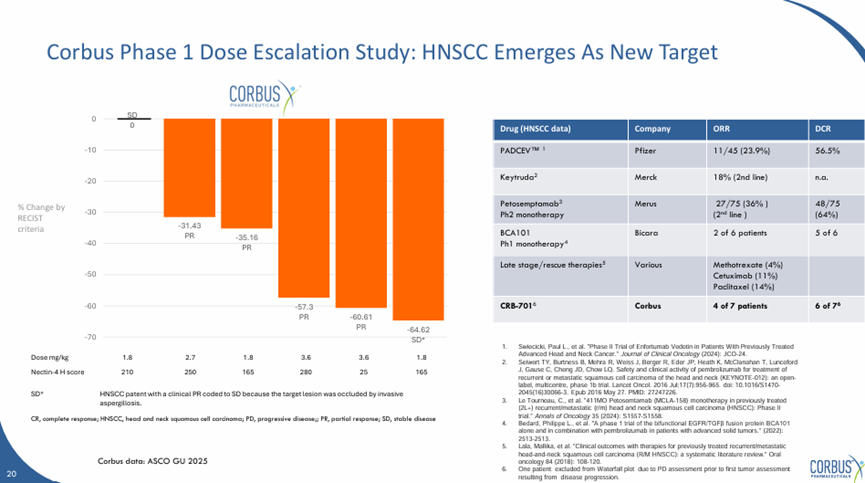
来源:Corbus官网
安全性方面,相较于目前其它Nectin-4的偶联药物,SYS6002表现出极 佳的安全性,特别毒素相关的不良反应要先祖低于其它产品,即便在4.5mg/kg也没有出现剂量限制性毒性,目前石药优先选择了2.7mg/kg和3.6mg/kg作为拓展组。
SYS6002(CRB-701)中国I期临床结果
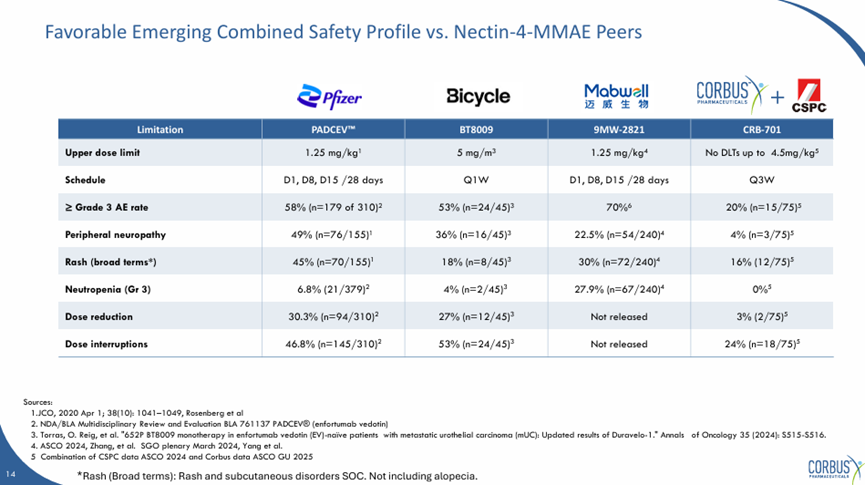
来源:Corbus官网
目前SYS6002在中国的I期临床试验仍在进行中,同时也启动了一项联合PD-1抗体在晚期尿路上皮癌及其他晚期实体瘤患者中I/II期临床试验,特别美国I期临床的一致性数据公布,也大大加强了产品开发的确定性,整体上基于其研发进度,以及初步有效性和安全性数据,未来值得期待。
虽然三款药物的开发让石药集团在ADC药物研发方面具有一定的先发优势,特别是定点偶联的技术平台初步得到临床验证,但是基于下一代ADC药物研发竞争不断升级,石药集团也再次将其ADC平台进行升级,同时也多个未公开的新靶点上进行了布局。
根据有限的专利公开显示,新ADC平台方面,药物毒素从MMAE过渡到自主开发的拓扑异构酶抑制剂毒素,具体方式为在第一三共基础上进行结构优化,或应用到EGFR、B7H3及HER3等多个新的ADC项目。
CPO301/SYS6010是临床中石药集团首 款,采用自主开发拓扑异构酶抑制剂毒素的ADC药物,连接子采用GGFG,DAR值为7左右。CPO301/SYS6010正在非小细胞肺癌及其它多个癌种中进行单药或联合治疗临床。
2024年1月2日,CPO301/SYS6010获NMPA授予突破性治疗认定,拟定适应症为单药用于经EGFR-TKI和含铂化疗治疗失败的EGFR突变阳性晚期非小细胞肺癌,其也将是全球首 款进入临床三期的采用扑异构酶抑制剂毒素的EGFR ADC药物,同时基于EGFR在多个癌种的高表达,CPO301/SYS6010未来市场不可限量。
除此之外,石药集团在连接子方面进行了诸多尝试,在VC和VA相关酶可裂解连接子的基础上,进行PEG亲水性优化处理,提高整体ADC药物特性,或应用到B7H3等新的ADC项目。
偶联方式上,石药仍然是定点偶联的技术持续推动者,通过计算机辅助药物设计对抗体进行建模,对溶剂可及性高及空间结构暴露的点进行谷氨酰胺突变,或者将抗体谷氨酰胺周围的氨基酸变为空间结构较小的氨基酸,或者插入带有Q氨基酸残基的短肽。
这样就可以提高谷氨酰胺的暴露,增加反应性谷氨酰胺数量,使得反应性谷氨酰胺成为mTGase酶催化的偶联位点,从而提高ADC药物的DAR值,或应用到ROR1等新的ADC项目中,将DAR值提高4。同时该平台最高可将dar值提高到10以上,以开发高药物负载的ADC药物。
总体来看,石药集团的ADC开发策略兼具创新性与务实性,通过差异化靶点选择和技术优化,展现出成为国内ADC领域头部玩家的潜力。石药集团以丰富的产品管线、先进的技术、国际化的布局以及顺利的临床进展,都为整个集团的发展奠定了坚实的基础,成为中国乃至全球ADC药物研发领域厚积薄发的新势力。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57