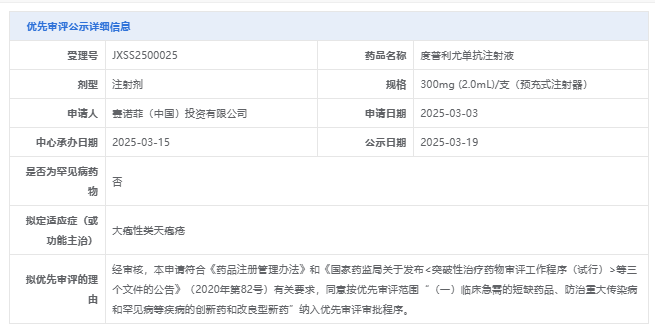
3月19日,国家药品监督管理局药品审评中心(CDE)官网公示,赛诺菲重磅自免上市药物度普利尤单抗注射液拟纳入优先审评,适应症为大疱性类天疱疮。
通过药渡数据库检索可知,度普利尤单抗(商品名:达必妥)是由再生元和赛诺菲双方共同开发的IL-4Ra/IL13抗体药物,最早于从2017年3月28日首次获FDA批准上市,2020年6月17日在国内首次获批,目前涵盖的适应症包括特应性皮炎、哮喘、伴有鼻息肉的慢性鼻窦炎、嗜酸性食管炎、结节性痒疹等。赛诺菲2024年财报显示,度普利尤单抗(Dupilumab)全球销售额高达141.79亿美元。
BP是一种慢性、使人衰弱和复发的皮肤病,具有潜在的2型炎症,其特征是剧烈瘙痒和水疱、皮肤发红和疼痛性病变。
赛诺菲在2025年美国皮肤病学会(AAD)年会公布Dupilumab在成人中度至重度大疱性类天疱疮(BP)关键ADEPT II/III期研究的积极结果,该研究的主要临床终点为36周时实现持续疾病缓解的患者比例;持续疾病缓解定义为完全临床缓解,在第16周完成口服皮质类固醇(OCS)减量,没有复发,且在36周的治疗期间没有使用挽救疗法。患者接受Dupilumab治疗36周,20%的患者经历了持续的疾病缓解,安慰剂组仅为4%(p=0.0114);40%的患者病情严重程度降低≥90%,安慰剂组为10%(p=0.0003);40%的患者瘙痒症状有临床意义的减轻,安慰剂组为11%(p=0.0006);平均累积OCS暴露量减少1678mg(p=0.0220),使用急救药物的风险降低54%(p=0.0016)。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57