一、卡瑞利珠单抗联合化疗一线治疗晚期鳞状NSCLC(SqNSCLC):III期CameL-sq研究5年数据更新
![]()
研究背景
在III期CameL-sq试验(NCT03668496),卡瑞利珠单抗联合化疗(Cam-化疗)1L治疗晚期鳞状非小细胞肺癌,患者无进展生存期(PFS)显著优于安慰剂组(PBO-化疗) 。本次数据为最后一例患者入组5年后的最新结果。
研究结果
研究中389名患者随机接受治疗(Cam-化疗,n=193;PBO-化疗,n=196)。截至2024年12月20日,从随机分组到数据截止(DCO)的中位时间为65.6个月(范围59.7-73.2)。Cam-化疗组对比安慰剂组中位OS为27.4 vs 15.5个月,5年OS率分别为27.8% vs 12.5%,安慰剂组中有97名(49.5%)患者交叉接受卡瑞利珠单抗单药治疗。亚组分析中均观察到卡瑞利珠单抗联用化疗一致的OS获益,在PD-L1 TPS<1%和≥1%的患者中,中位OS分别为19.8 vs 14.4个月和38.4 vs 20.1个月,在 Cam-化疗组完成2年卡瑞利珠单抗治疗的39名(20.2%)患者中,中位DoR为61.4个月(95% CI 32.4-NR);5年OS率为84.0%(95% CI 67.9-92.5)。Landmark分析进一步显示,接受卡瑞利珠单抗治疗2年或生存时间≥5年的患者更有可能具有PD-L1阳性表达,并且在基线时具有不同的肿瘤突变模式。未观察到新的安全性信号。
结论
卡瑞利珠单抗联合化疗经过长期随访表明具有显著临床获益,且临床不良反应可控,超过25%的患者在5年时仍存活,进一步支持该方案作为晚期鳞状非小细胞肺癌的标准1L治疗方案。
二、度伐利尤单抗联用或不联用Tremelimumab联用化疗作为转移性NSCLC的一线治疗:III期POSEIDON研究中国扩展队列的结果
![]()
研究背景
POSEIDON研究(NCT03164616)是一项全球多中心、随机、开放标签的III期临床研究,该研究评估了在1013例EGFR/ALK野生型转移性NSCLC患者中,一线治疗接受度伐利尤单抗(D)±CTLA4抑制剂Tremelimumab(T)和化疗(CT)疗效和安全性。在对全球入组患者进行的最终分析中,D+T+CT与CT相比,在无进展生存期(PFS;HR 0.72;95% CI 0.60-0.86;p=0.0003)和总生存期(OS;HR 0.77;95% CI 0.65-0.92;p=0.0030)方面均有统计学意义上的显著改善。D+CT与CT相比,PFS明显改善(0.74;95% CI 0.62-0.89;p=0.0009),OS改善呈阳性趋势(HR 0.86;95% CI 0.72-1.02;p=0.0758)。在中国入组的扩展队列中进行了预先指定的探索性分析。
研究结果
175名中国患者接受随机分组,其中PD-L1≥50%的患者占比为30.3%,48.0%的患者患有IVB期疾病,48.6%的患者患有鳞状组织学。CT方案在各组之间的分布如下图。在PFS最终分析和OS期中分析的数据截止时(2024年4月30日;删失患者的OS中位随访期:24.1 [0-42.1]个月),D+T+CT及D+CT对比CT治好方案的PFS和OS显著改善(如下图)。3/4级治疗相关不良事件(TRAE),在接受D+T+CT、D+CT和CT的患者中分别占65.5%、62.3%和49.1%,TRAE导致患者死亡三组分别为5.2%、0%和0%;因TRAE而导致患者停止治疗三组分别为22.4%、11.3%和12.3%。
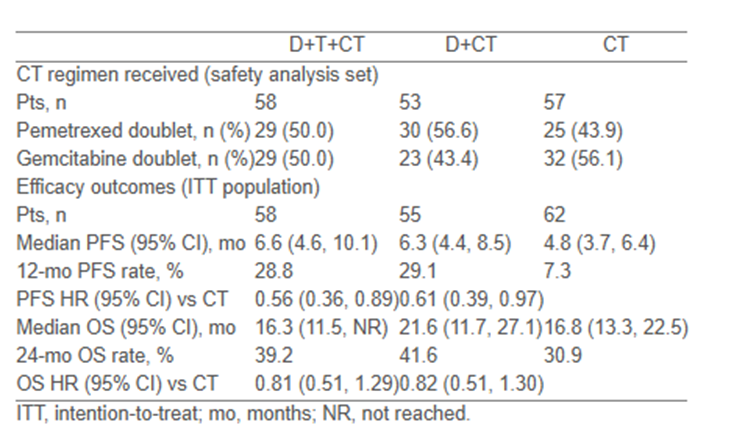
结论
中国队列中D+T+CT和D+CT vs CT的疗效和安全性与POSEIDON全球研究的最终结果基本一致。
三、奥希替尼联用Dato-DXd用于治疗既往经奥希替尼一线治疗(1L)治疗后疾病进展的EGFR突变晚期非小细胞肺癌患者:ORCHARD研究

研究背景
ORCHARD(NCT03944772)是一项开放标签、多中心、多药物、生物标志物指导的II期临床研究,研究纳入经奥希替尼一线治疗发生疾病进展的EGFR突变晚期NSCLC患者。
研究结果
患者接受口服奥希替尼(Osi 80mg QD)+静脉注射Dato-DXd(4或6mg/kg Q3W,分两组)。招募从4mg组开始,并扩展到6mg组,随后同时招募两种剂量水平的患者。DCO:2024年10月12日。69名患者接受了Osi+Dato-DXd治疗。4mg组(n=35)和6mg组(n=34)的中位治疗持续时间分别为9.0和9.8个月;中位随访时间分别为13.4和13.8个月。在68名可评估患者中,两组ORR相近(4/6mg:43/36%);两组PFS中位数分别为9.5和11.7个月;OS不成熟(成熟度为37%)。任何治疗相关≥3级AE,两组4/6mg:34/56%;AE导致Dato-DXd剂量减少(4/6mg:23/59%);判定为ILD/肺炎(4/6mg:任何级别,3/15%;≥3级,3/6%)。
结论
奥希替尼联用Dato-DXd在1L奥希替尼治疗后病情进展的EGFRm aNSCLC患者中表现出良好的疗效和可控的安全性。没有新的安全信号。考虑到整体效益及风险状况,6mg/kg可作为Dato-DXd与奥希替尼联合应用的推荐起始剂量。
四、埃万妥单抗联用拉泽替尼对比奥希替尼一线治疗EGFR突变晚期非小细胞肺癌:III期MARIPOSA研究的最终OS数据

研究背景
既往报道MARIPOSA研究(NCT04487080;中位随访时间:22.0个月),埃万妥单抗联用拉泽替尼(ami+laz)一线治疗EGFRm晚期NSCLC患者显著改善无进展生存期(PFS)(HR?0.70;P<0.001),且在不同风险组中均显示出一致的获益。在中期OS分析和31.1个月随访后,ami+laz与奥希替尼(osi)相比显示更佳的OS获益趋势。目前ami+laz已获得美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)批准用于EGFRm晚期NSCLC的一线治疗。在FLAURA试验中,奥希替尼作为EGFRm晚期患者一线治疗,其OS比第一代TKIs 延长了约7个月(mOS,38.6个月 vs 31.8个月)。本次报告了MARIPOSA试验中ami+laz与osi OS的最终分析结果。
研究结果
中位随访37.8个月,ami+laz组OS对比奥希替尼组,具有统计学意义和临床意义的显著改善(死亡风险比,0.75;95%CI,0.61-0.92;P<0.005)。ami+laz组mOS无法估计(NE;95%CI,42.9-NE),奥希替尼组为36.7个月(95%CI,33.4-41.0)。假设两组的OS均呈指数分布,预计ami+laz组mOS相较奥希替尼组延长至少12个月。在36个月时,ami+laz组有60%的患者存活,而奥希替尼组为51%。
五、SAVANNAH:赛沃替尼联用奥希替尼用于治疗既往奥希替尼用药后进展的EGFR突变伴MET过表达和/或扩增晚期NSCLC患者

研究背景
赛沃替尼(savo)是一种口服、强效且高选择性MET小分子抑制剂,与奥希替尼(osi)联用,可能克服奥希替尼治疗EGFR突变型晚期非小细胞肺癌后产生的获得性MET驱动的耐药性。本次报告了临床II期SAVANNAH研究(NCT03778229)的初步结果,旨在评估了savo+osi在此情况下的有效性和安全性。
研究结果
数据截止日期:2024年8月23日,入组患者为患有EGFR突变的晚期NSCLC且在osi治疗后疾病进展,出现MET过表达和/或扩增。研究共纳入了101例患者,给药方案赛沃替尼300mg,每日两次,联用奥希替尼80mg,每日一次。有80例主要疗效人群中,研究评估的ORR为56%(95% CI 45-67),与BICR ORR相似, 57%的患者发生了Gr≥3 AE(Gr≥3 TRAE 32%);SAE 31%;导致停止使用savo/osi的AE为16%/12%。最常见不良事件(>20%):外周水肿58%、恶心45%、腹泻33%、呕吐21%。未出现新的安全问题。
结论
赛沃替尼300mg BID联用奥希替尼耐受性良好,在MET IHC 3+/≥90%和/或FISH10+状态的EGFR突变晚期NSCLC患者中表现出临床意义和持久响应。
六、TROPION-Lung14:奥希替尼±Dato-DXd一线治疗EGFR突变局部晚期或转移性(LA/M)非小细胞肺癌(NSCLC)患者的临床III期研究

研究背景
TROPION-Lung14(NCT06350097)是一项全球、随机、多中心、开放性III期研究,旨在评估奥希替尼±Dato-DXd作为EGFR突变LA/M NSCLC患者的一线疗法的疗效和安全性。
试验设计
研究招募经组织学或细胞学确诊的IIIB/IIIC或IV期非鳞状、EGFR突变(外显子19缺失或L858R)NSCLC患者(年龄≥18岁),既往未接受过EGFR酪氨酸激酶抑制剂或其他IIIB/IIIC或IV期疾病全身治疗,根据RECIST 1.1至少有一处可测量病变,WHO体能状态(PS)为0或1。在随机研究期之前,约20名患者将在非随机单组安全性试验中接受奥希替尼+Dato-DXd治疗。安全性测试完成后,约562名患者将按1:1的比例随机分配接受奥希替尼(80mg口服QD)或奥希替尼(80mg口服QD)+Dato-DXd(6mg/kg IV Q3W)。患者将根据EGFR突变类型(Ex19Del vs L858R)、WHO PS(0 vs 1)和中枢神经系统(CNS)转移状态(是vs否)进行分层。治疗将持续到RECIST v1.1定义的进展或不可接受的毒性。主要研究终点是盲法独立中央审查评估的无进展生存期(PFS)。总生存期是关键的次要终点;其他次要终点包括研究者的PFS、客观缓解率、缓解持续时间、PFS2、安全性、药代动力学和免疫原性。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57