CAR-T,即嵌合抗原受体-T细胞(Chimeric Antigen Receptor T-cell),其中CAR是一种人工构建的细胞表面受体,由能够识别肿瘤抗原的胞外单链抗体可变区和胞内信号传导区域组成。T细胞过表达CAR分子后,能识别癌细胞表面的肿瘤抗原并被激活,从而特异性杀伤肿瘤细胞。
CAR-T产品治疗过程
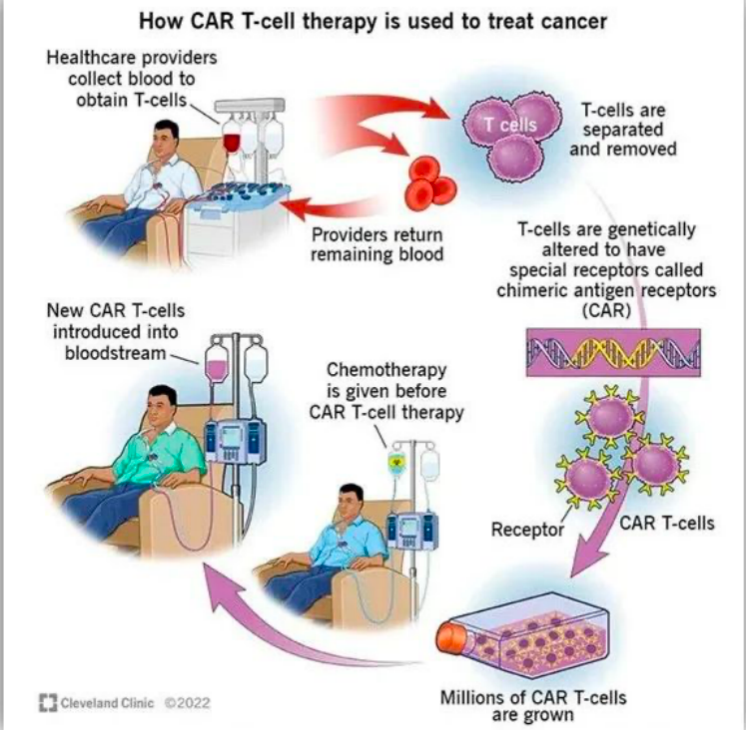
自从2017年8月首个CAR-T细胞产品Kymriah获FDA批准上市以来,这一疗法在短短数年间进行了多次迭代。
然而,当前的CAR-T产品,无论是自体还是通用型,均是体外CAR-T疗法(ex vivo CAR-T),需要从患者身上收集细胞,并在体外对这些细胞进行改造及培养,最后再将CAR-T细胞重新回输到患者体内,因此面临生产、运输、安全挑战、价格高昂等多重挑战。在这种背景下,如何使CAR-T疗法变得更完美,成为药企的主旋律。近日,阿斯利康一笔高达10亿美元的交易,使得体内CAR-T疗法(in vivo CAR-T)再次被点燃。
110亿美元,阿斯利康豪赌体内CAR-T
3月17日,阿斯利康宣布,以总对价10亿美元(约72.4亿元人民币)收购比利时生物技术公司EsoBiotec,创下本年度细胞与基因治疗(CGT)领域最高收购金额。EsoBiotec成立于2020年,是专注于体内CAR-T领域的新锐公司。其独有的工程纳米抗体慢病毒(ENaBL)平台,为癌症治疗领域带来了创新性突破。ENaBL以具备免疫屏蔽特性的慢病毒作为载体,这类载体能有效抵御免疫系统攻击,确保将遗传指令精准传递至T细胞,从而在体内高效地将T淋巴细胞重编程为特定功能细胞。
依托ENaBL平台,EsoBiotec已布局四条临床候选管线,其中针对多发性骨髓瘤的候选管线ESO-T01(BCMA CAR-T)已进入临床研究阶段。ESO-T01可精准识别并紧密结合表达BCMA的肿瘤细胞,激活免疫反应以杀伤肿瘤,展现出极高的精度与效力。此次收购完成后,EsoBiotec将成为阿斯利康的全资子公司,在比利时开展业务。
在收购EsoBiotec之前,阿斯利康于2023年底,更是豪掷12亿美元收购亘喜生物。亘喜生物针对CAR-T行业的诸多瓶颈,开发出了FasTCAR次日生产技术平台,该平台可将传统工艺长达数周的生产周期大幅缩减至次日,并且能够强化T细胞健康状态,以及节省治疗费用等,有望为CAR-T细胞疗法的生产及临床应用带来重要变革。2022年,FasTCAR自体CAR-T技术平台被正式评选为2022年Fierce Life Sciences年度创新奖之“生物技术创新奖”。
亘喜生物基于FasTCAR平台打造的BCMA/CD19双靶点CAR-T疗法GC012F备受关注,也是吸引阿斯利康收购的重要因素。GC012F可同时靶向B细胞成熟抗原(BCMA)和CD19双靶点,目前研究者已发起多项临床试验,包括评估其治疗复发/难治性多发性骨髓瘤(RRMM)、初诊多发性骨髓瘤(NDMM)以及B细胞非霍奇金淋巴瘤的安全性和有效性等,另外还在中美两地获批用于治疗难治性系统性红斑狼疮适应症的临床试验。
除了外部BD获得的CAR-T产品外,阿斯利康还自研或合作开发了CAR-T产品AZD7003(靶向GPC3)、AZD0754(靶向Steap2)和AZD6422(靶向Claudin18.2)。虽然阿斯利康在CAR-T赛道入局并不算早,但其正在用实际行动展示押注下一代CAR-T技术的决心。那么,关于阿斯利康押注的体内CAR-T技术,目前研发进展如何?
改变游戏规则的体内CAR-T,多家药企竞逐
体内CAR-T是指通过保护性载体,将嵌合抗原受体(CAR)分子载送至患者T细胞内,并让这些T细胞在体内自动转化为CAR-T细胞。与传统CAR-T疗法相比,体内CAR-T不需要从患者体内提取CAR-T细胞,也不需要提前进行淋巴细胞清除的预处理,不仅整个治疗等待时间更少,而且无需专门的定制化处理。
在安全性上,由于CAR-T细胞来自患者自身,大幅降低了“通用型CAR-T”常见的细胞因子释放综合征等发生风险。
鉴于一系列优势,体内CAR-T可能会改变全球市场的游戏规则,吸引了MNC和Biotech竞相布局。由于体内CAR-T是通过不同的手段直接在体内进行基因修改,因此如何将编码CAR的基因或mRNA精准高效地递送至患者体内的T细胞,并且不影响其他细胞,是该技术开发的关键。
目前,常用的递送系统包括病毒载体、mRNA递送系统(LNP)以及基因编辑技术,以前两种为主。目前,以病毒载体为递送手段的代表公司有Interius BioTherapeutics、Umoja Biopharma和Kelonia Therapeutics等。Interius BioTherapeutics(以下简称“Interius”)是全球体内CAR-T研发进度最快的公司之一。
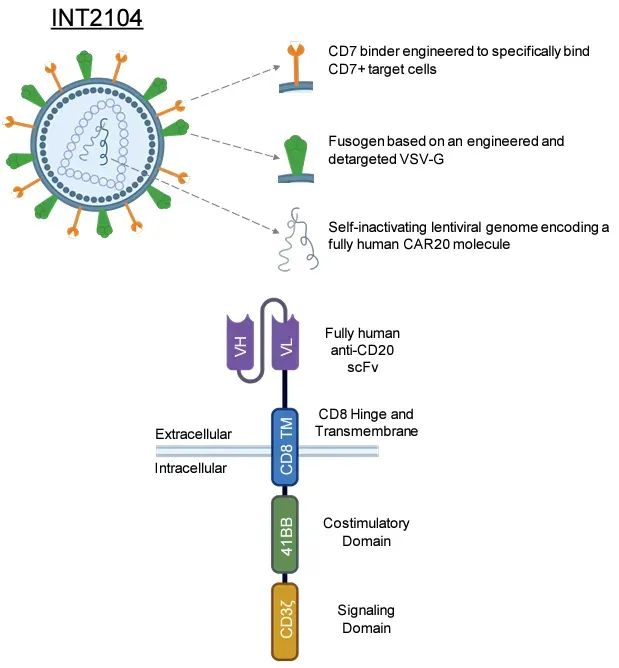
去年7月,公司在研体内CAR-T疗法INT2104宣布获澳大利亚治疗用品管理局(TGA)批准进入临床试验,用于治疗B细胞恶性肿瘤。INT2104是一种慢病毒载体基因疗法,设计靶向CD7阳性的T细胞和NK细胞,并传递CAR转基因,以在体内生成效应CAR-T和CAR-NK细胞。这些CAR细胞靶向CD20阳性B细胞,用于治疗B细胞恶性肿瘤。据悉,INT2104是首个进入人体临床试验的体内CAR-T疗法。
INT2104设计示意图
Umoja Biopharma(简称Umoja)拥有四大核心技术平台:VivoVec采用专有的第三代慢病毒载体技术,可使人体自行制造CAR-T细胞;RACR/CAR能够对体内细胞进行编程,促进体内产生的CAR-T细胞长期存活和扩张;iCIL利用RACR技术从诱导的多能干细胞中大规模生产合成抗癌细胞,增强内源性抗肿瘤免疫功能;TumorTag通过将通用CAR与离体制造的细胞结合,提高了靶向灵活性。
VivoVec平台作用机制
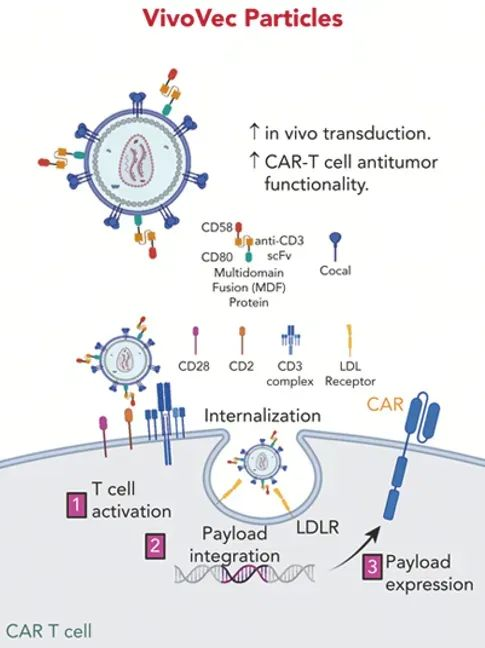
Umoja基于VivoVec平台,研发了体内CAR-T疗法UB-VV111(靶向CD19),该产品已在去年7月底获FDA批准,进入临床试验,用于血液瘤治疗。
在此之前,艾伯维已和Umoja达成独家合作协议,以使用Umoja专有的VivoVec平台开发CAR-T细胞疗法候选药物。该交易总金额高达14.4亿美元。Kelonia Therapeutics(简称Kelonia)对传统的慢病毒载体(LVV)进行了修饰,其iGPS技术建立在LVV的基础上,在病毒包膜上采用了独特定义iGPS粒子特异性的靶向分子和优化的融合蛋白(fusogen)设计,在目标免疫细胞识别出LVV表面特殊抗原并与之结合后,促融合分子才会对免疫细胞进行转导,进行基因递送,提高了基因递送的精确性和高效性。
2024年2月,安斯泰来与Kelonia达成合作协议,将利用Kelonia的iGPS技术,来开发针对至多两个项目的创新体内CAR-T细胞疗法。目前在研CAR-T产品大多采用病毒载体,虽然这可使疾病获得长期缓解,但病毒载体具有制作成本高以及致癌风险等,因此,在体内CAR-T研发中,非病毒载体的技术突破已成为关键。目前非病毒载体主要代表是脂质纳米颗粒(LNP),其具有可大量生产、免疫原性低的优点,而且不插入基因组因而避免了基因突变风险。
LNP技术曾在新冠疫苗中大放异彩,而今被迅速应用到CAR-T领域。Capstan Therapeutics公司开发了抗体偶联的LNP(Cellscope平台),利用特异性的抗CD8抗体修饰,将载有CAR mRNA的脂质纳米颗粒靶向递送至T细胞。
这种策略能在体内快速将患者的T细胞转化成为CAR-T细胞。Capstan因此被行业媒体Endpoints News评为“2024生物医药最 具潜力新锐”。2024年3月,Capstan完成了1.75亿美元的B轮融资,投资者阵容豪华,强生、BMS、礼来、拜耳、诺华、辉瑞等制药巨头均现身。除Capstan外,Myeloid Therapeutics、Orbital和Orna等公司均利用LNP递送RNA技术,以诱导靶细胞中CAR表达的短暂激增。目前全球已有多个体内CAR-T候选产品已经或即将进入临床。
关于CAR-T治疗我们在追求什么?
CAR-T技术从开发至今经历了数次迭代,对于CAR-T治疗,行业一直在追求极 致的路上。
对于体外CAR-T来说,如何缩短生产时间,简化制备过程,降低高昂的成本、物流费用等是药企亟需解决的问题。
另外,对于一些T细胞质量或数量较差的患者,体外改造可能并不适用。对于体内CAR-T来说,如何提高载体的安全性依然是面临的主要挑战,其次是如何在治疗窗口期内确保足够的表达和免疫激活。除此之外,由于体内环境复杂,如何在体内生成并维持具有长期持久性的CAR-T细胞群体,也是体内CAR-T面临的一个重要挑战。
无论对于体外还是体内CAR-T,目前主要阵地仍是血液瘤,下一步,适应症拓展是关键,如实体瘤、自免等其他未满足大量需求的适应症。
总之,CAR-T技术融合了基因编辑、载体工程、分子靶向等多方面尖端技术。诚然,和所有革命性发明一样,CAR-T药物并不完美,至今也仍然在持续优化的道路上。通过不断优化递送工具和靶向策略,药企正逐步攻克CAR-T疗法的技术壁垒。随着这些创新的积累,有望掀开细胞治疗的新篇章。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57