近日,笔者在药物临床试验登记与信息公示平台上发现了一则信息,如下所示:

这不看不知道,一看吓一跳啊,开展这项临床试验的正是国内的研发一哥恒瑞,笔者点进去又发现了更为详细的信息,该条信息首次公示日期为2017年7月27日,如下所示:
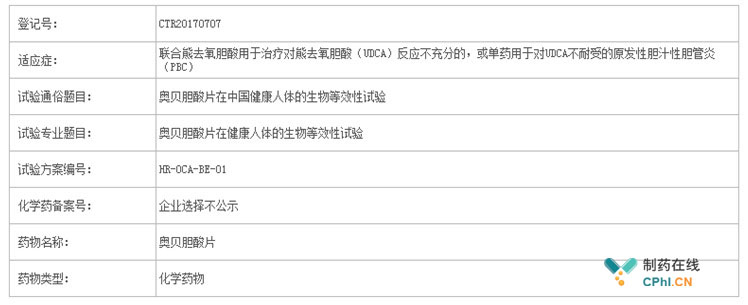
也就是说,恒瑞已经开始仿制这个去年刚在美国上市的药物,是要开始进军脂肪肝领域了吗?!下面笔者带你一探究竟。
20年内获批的唯一一个治疗PBC的药物
奥贝胆酸(商品名:Ocaliva)是美国Intercept制药公司研发的一种胆汁酸类似物,是FXR(法尼酯X)受体的全新激动剂,间接抑制细胞色素7A1(CYP7A1)的基因表达,抑制胆酸合成,其中FXR是表达于肝 脏和小肠中的一种核受体,是胆汁酸、炎症、纤维化、代谢通路中的关键调节因子。该药于2016年5月31日被FDA批准联合熊脱氧胆酸(UDCA)用于UDCA单药治疗应答不佳的原发性胆汁性胆管炎(PBC)成人患者,或单药用于无法耐受的PBC成人患者,是继UDAC被授予孤儿药批准后的20年内,第二个用于原发性胆管炎(PBC)患者的药物,同年11月获EMA批准。Intercept拥有奥贝胆酸在日本、中国、韩国以外地区的全球权力,在日中韩地区,Intercept已将该药授权给日本住友制药。
PBC是一种罕见病,全球发病率仅为万分之二十七,人们更加看中的是奥贝胆酸在治疗非酒精性脂肪性肝炎(NASH)方面的优秀表现。
全球潜在市场规模高达400亿美元的NASH
NASH是一种肝内脂肪积聚而导致的慢性进展性肝病,可导致肝硬化、肝衰竭及肝细胞癌,确切的说,NASH只是非酒精性脂肪性肝病(NAFLD)病程发展的一个阶段。笔者特意画了一张图,让大家了解以下NASH到底是个什么样的疾病。
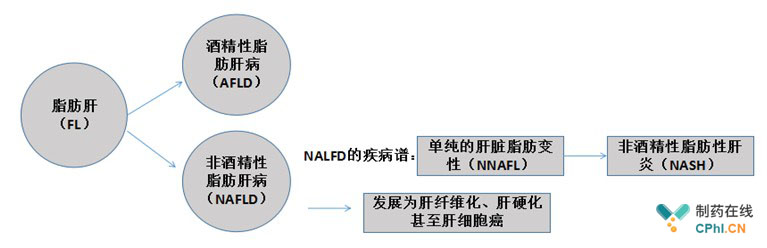
全球范围内,NASH的发病率为2%-3%[1],中国发病率略低于西方。根据EvaluatePharme的预测,全球NASH药物的市场规模在2025年将达到400亿美元,而根据IMS数据,2020年我国护肝降酶药保守市场规模也高达120亿元。NASH巨大的市场规模吸引了众多生物医药公司,有不少生物技术公司都在开展各自候选药物的临床前研究工作,但大多都还处于非常早期的阶段。
奥贝胆酸是全球第一个进入Ⅲ期临床的NASH药物
由于NASH发病机制还不是很明确,因此在研药物的作用靶点相对分散,目前NASH治疗靶点及相应制剂主要有以下几种:(1)选择性外周大 麻素受体阻滞剂;(2)过氧化物酶体增殖物激活受体(PPAR)α/δ双激动剂;(3)FXR(法尼酯X)受体激动剂;(4)半胱氨酸天冬氨酸蛋白酶(Caspase)抑制剂;(5)选择性磷酸二酯酶(PDE)抑制剂等。
奥贝胆酸作为一种FXR受体激动剂,在2015年1月被FDA授予治疗NASH的突破性药物资格,是全球第一个进入III期临床的NASH药物,2015年9月正式启动III期研究,可以说是所有在研NASH药物中最受关注的一个。
然而,奥贝胆酸的临床试验并不顺利。此前,该药临床成功的标准是需要同时到达"1,肝纤维化程度至少改善1级且NASH没有恶化的患者比例;2,肝 脏蓄积脂肪被清除且纤维化程度没有恶化的患者比例"的复合终点且终点指标需要用肝组织活检来检测。这个非常激进的指标导致患者招募进度未达到预期,今年2月份,获FDA批准将同时到达复合终点更改为只要到达其中一个终点。此外,日本的NASH二期临床试验数据显示,奥贝胆酸疗效并不达标,只有当剂量增加到40mg才与安慰剂组有显著差异。奥贝胆酸能不能用于治疗NASH充满未知数。
恒瑞开发NASH的优势与劣势
由于PBC属于罕见病,且中国尚无罕见病政策,因此笔者大胆推测恒瑞的最终目标是开发该药的NASH适应症,为此笔者分析了仿制奥贝胆酸治疗NASH的优势和劣势:
优势:(1)目前除了恒瑞,尚无公司申报该药相关临床;(2)NASH是公认的下一个大市场,2020年我国NASH市场将会突破120亿;(3)奥贝胆酸化合物专利为WO2005082925并未进入中国,进入中国的奥贝胆酸及其衍生物的专利主要集中在晶型和制备工艺专利上;(4)竞争对手Elafibranor疗效也不佳,其它的NASH药物还处于二期,落后奥贝胆酸三年左右。
劣势:(1)奥贝胆酸严重的瘙痒反应和心血管事件,奥贝胆酸在5mg剂量时就产生显著的瘙痒反应(NASH剂量可能要加至40mg),在PBC三期临床中,有3%的患者出现严重的心血管事件;(2)日本NASH二期临床试验疗效不达标,只有当剂量增加到40mg才与安慰剂组有显著差异;(3)奥贝胆酸一年的治疗成本接近7万美元,国内没有人吃的起,在现有的药政制度下,仿制药开发成本高达2000余万元;(4)对手进度抢先,奥贝胆酸的NASH的研究进度落后于Elafibranor,而且可能有数个竞争药物与奥贝胆酸同步上市;(5)药品一致性评价对仿制药影响巨大,绕开化合物专利涉及的晶型可能会存在一定的难度。
以上均为笔者一家之言,有争议的地方随时欢迎读者留言讨论哦!
附:NASH研发管线(截至2017年8月)
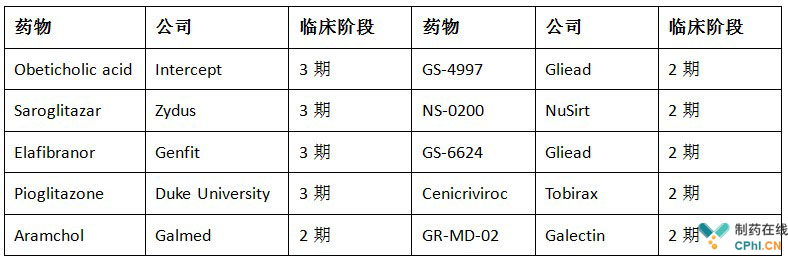
(更多NASH药物动态,可关注网站:http://nashbiotechs.com/the-nashworld.html)
参考文献:
[1]汤森路透2016年最值得关注的药物预测



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57