美国FDA作为全球药政监管的领头羊和风向标,FDA对制药行业的管理措施和法规动向一直是制药人需要密切高度关注的。在2018年第一季度,FDA共发布生产质量类警告信17个(其中1月份6个,2月份7个,3月份4个),具体信息如下表:
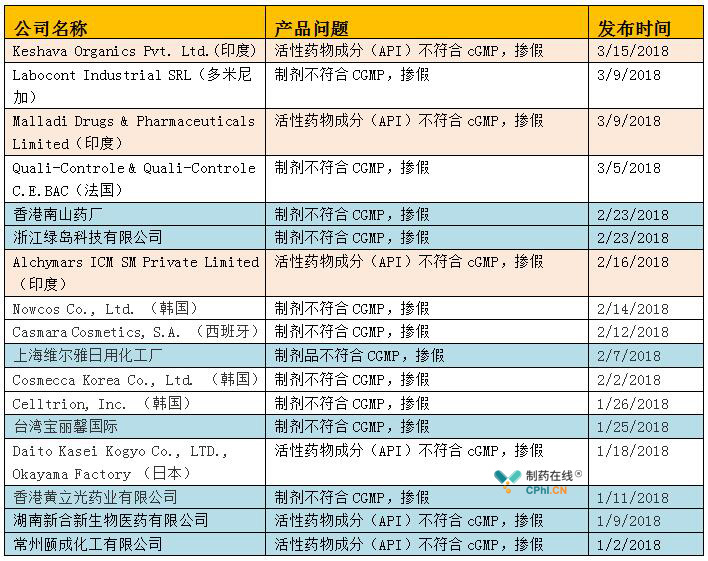
表1 2018年第一季度FDA警告信基本信息
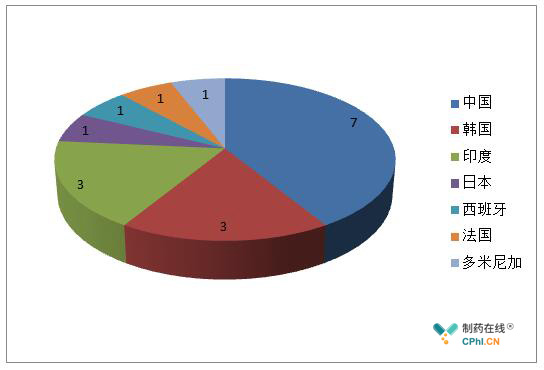
图1 FDA 2018年一季度警告信国家分布图
我们对第一季度的警告信作了简要分析,从分布国家来看,中国居首,占比41%,其次是印度和韩国。FDA致力于保障消费者的健康和安全,印度和中国一直以来是FDA持续关注的对象,尤其是2017年11月1日,美国与欧盟(EU)人用药用互认检查协议(MRA)正式开展以来,欧盟和美国的检查资源将重新布局,印度和中国作为两个制药大国,而且近年来问题频现,势必会成为检查资源倾斜的重心,应重点关注。从警告信国家分布来看,这种检查资源的布局,有可能会向整个亚洲倾斜。另外,在特朗普贸易保护主义的影响下,FDA对于亚洲药品制造商的监管,预计还会持续保持严管态势。
另外一方面,警告信中制剂较多(11个),原料药(API)较少。但是这一点并不意味着FDA对于原料药企业检查频次减少。因为2018年底第一季度的警告信所代表的检查行为,往往是2017年第三季度和第四季度所实施的。所以说,目前我们看到的第一季度制剂企业警告信多于原料药企业,说明FDA本身对于制剂企业就一直检查严格管控力度;另外,可能2017的第三季度和第四季度对于原料药企业检查频率较少所导致。
下面我们重点看一下检查出来的主要问题:
原料药企业存在的问题还比较肤浅,例如Failureto adequately investigate out-of-specification results and implementappropriate corrective actions.未能充分调查OOS结果,并实施适当的纠正措施。(Warning Letter 320-18-41,Keshava Organics Pvt. Ltd.)
Failure to use appropriate precautions to minimize the risk of API contamination where open equipment is used. 使用开放设备时未使用适当的预防措施以降低API污染风险;Failure to demonstrate that your manufacturing process can reproducibly manufacture an API meeting its predetermined quality attributes. 未能证明你们的生产工艺可以重复生产出符合其预定质量属性的API。(Warning Letter 320-18-40 Malladi Drugs & Pharmaceuticals Limited)
Failureto have laboratory control records that include complete data derived from alllaboratory tests conducted to ensure your API complies with establishedspecifications and standards. 没有化验室检测记录,在其中包括为确保你们API符合既定质量标准所实施的所有化验室测试所生成的完整数据;Failureto properly maintain equipment and to keep complete records of major equipmentmaintenance. 未能对设备进行妥善维护,并保存主要设备维护的完整记录。(Warning Letter 320-18-35 Alchymars ICM SM Private Limited)
工艺验证、化验室基础管理,生产、设备管理这些问题都是药品生产企业在生产以及质量日常管理中极其常见且最基础的GMP管理内容,这些方面仍存在较大差距和缺陷值得我们深思,因此也可以看出一些API生产企业GMP基础的薄弱以及生产者GMP意识的薄弱。
制剂企业中存在的问题,QC化验室部分居多,如分析方法的验证缺失Your firmfailed to establish and document the accuracy, sensitivity, specificity, andreproducibility of its test methods (21 CFR 211.165(e)). 你公司未能建立和记录其检测方法的准确度、灵敏度、专属性和重现性(21 CFR211.165(e)),分析测试数据的完整性问题频现Your firmfailed to ensure that laboratory records included complete data derived fromall tests necessary to assure compliance with established specifications andstandards (21 CFR 211.194(a)). 你们公司未能确保化验室记录中包括所有必须测试中所生成的完整数据,这些测试是为了确保产品符合其既定标准(21 CFR 211.194(a))。
原辅料鉴定及供应商管理缺陷,Your firmfailed to conduct at least one test to verify the identity of each component ofa drug product. Your firm also failed to establish the reliability of componentsupplier analyses on which you rely in lieu of certain tests throughappropriate validation of supplier's test results at appropriate intervals (21CFR 211.84(d)(1) and (2). 你公司未执行至少一项检查以核查药品的每种成分的鉴别。你公司亦未以适当的时间间隔适当地验证供应商检测结果来建立你们组份供应商分析的可靠性就依赖于他们的分析数据来替代某些检查(21 CFR211.84(d)(1) and (2)。
纵观警告信中列举的这些缺陷,多数都是日常管理中常见的问题,而且很容易避免,很多很肤浅的问题频频出现在警告信中,恰恰暴露了GMP管理的实质,就是基础管理和细节管理,质量体系的建立不是一朝一夕的,质量意识的薄弱是导致被警告的基本原因。
根据上面对2018年底第一季度FDA所签发警告信的分析,我们可以看出,一个制药要想在规范市场保持良好信誉,必须从基础入手,扎扎实实推进质量体系建设。搞运动式管理可能会取得一些阶段性进展,但是从长远看,持续合规需要的体系不断完善和持续提高。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57