
中国是中药的发源地和主要生产国家。随着历史的发展,中药随着华人的足迹也开始向全球扩展。欧盟境内使用中药的历史也具有很长时间。但是不同的是,欧盟各国药政当局对于中药管理和中国对于中药管理有一定差距:第一就是欧盟把传统中药的一部分摈弃掉,只选择植物药来作为药品来使用和管理;而对于矿物药和动物药,出于保护动物和人体安全考虑,不认可中药中的矿物药组分和动物来源组分。第二方面,即使采用植物药,欧盟官方也认为植物药组方尽量简单;一般植物药制剂的药材来源不超过3种,过多处方组分形成的复杂效应是很难控制和评价的。
自2003年欧盟实施植物药简化注册以来,随着注册要求提高,中国境内的制药企业产品在欧盟以药品身份注册的植物药愈发减少,目前不超过10种;这显然和中国作为中药发源地和中药生产大国不相称。为了更好的让中国中药企业了解欧盟对于传统植物药的管理政策,笔者对欧盟《Questions & Answers on the EU framework for (traditional) herbal medicinal products, including those from a 'non-European' tradition》进行编译和解读,希望可以对国内企业有所裨益。这份政策问答包含24个技术问题,分为三部分进行介绍。
根据这份文件的结果,问题1-7主要介绍欧盟境内植物药管理的法规。
问题1:在欧盟境内,我们在哪里可以找到中草药产品立法和卷宗材料的要求?
答案1:欧盟的药品立法可以在欧洲委员会的网站找到:
http://ec.europa.eu/health/human-use/index_en.htm
欧盟医药部门立法的主体是在第1卷和第5卷出版物《欧盟药品管理规则》汇编的。基本立法由其它卷(2-4,6-10)中发表的一系列指导方针支持。10卷构成了所谓的Eudralex。
http://ec.europa.eu/health/documents/eudralex/index_en.htm
上述出版物的第2卷被称为《通知申请人》(NtA)。欧洲委员会已与各成员国主管当局和欧洲药物管理局(EMA)协商,编写了一份有关程序和监管要求的监管指南清单。NtA不具有法律约束力,也不一定代表欧盟委员会的最终意见。因此,如果有疑问,应参照适当的欧盟指示和条例。
http://ec.europa.eu/health/documents/eudralex/vol-1/index_en.htm
在第2A卷第1章中,详细解释了营销授权程序,并描述了不同的程序,包括传统草药产品的程序。
在提交营销授权申请时,申请人必须在卷宗的管理模块1中注明提交卷宗的申请类型。
申请类型参见问题5。
第1章提供了关于挪威、冰岛和列支敦士登对欧盟(欧盟28个成员国、挪威、冰岛和列支敦士登组成的欧洲经济区)药品批准的决定的信息。
问题2:什么是中草药产品、中草药材和中草药制剂?
回答2:定义见指令2001/83/EC第1章:中草药产品: 任何含有一种或多种中草药材或一种或多种草药制剂作为活性成分的药物产品,或一种或多种中草药材与一种或多种草药制剂相结合的任何药用产品。
中草药材:主要为整株、破碎或切割植物、植物部分、藻类、真菌、地衣等未经加工的,通常为干燥的形式,但有时是新鲜的。某些未经过特殊处理的分泌物也被认为是草药。
中草药材是由所用的植物部分和根据二项系统(属、种、变种和作者)的植物学名称精确定义的。
中草药制剂:通过对中草药材进行萃取、蒸馏、表达、分馏、纯化、浓缩或发酵处理而得到的制剂。
这些成分包括粉状或粉末状的中草药、酊剂、提取物、精油、榨出的果汁和经过处理的分泌物。
问题3:在这个问答文件的框架中,"非西方医学体系"含义是什么?
回答3:在一份"根据指令2001/83/EC(修订后为指令2004/24)第2a章的规定获得的经验,适用于传统草药产品的具体条文的报告"( COM (2008)-584)中,欧盟委员会提到了一些非欧洲医学系统,其中传统的中草药经常用到:印度阿育吠陀医学、中医药(TCM)以及汉方医学(Kampo)、韩国、蒙古、泰国、藏、Unani和越南传统药物。
在欧洲委员会的报告中,阿育吠陀医学和传统中医被引用为非西方传统医学体系的例子。这些药物体系在世界其他地区已经存在了几个世纪,并且有自己的特定产品,其中一些可以作为欧盟的传统草药产品。
根据指令2001/83/EC-人用药品,欧盟的立法规定了对传统草药产品的具体要求。这项立法规定了在市场上放置产品的程序,是基于特定产品的方法,并没有规范传统医学的做法。
问题4:什么是传统的草药产品?
回答4:传统草药产品是人用的草药产品,满足第2001/83/EC号指令第16a(1)条规定的条件:
1、它们有专门针对传统草药产品的适应症,根据其组成和用途,可以在没有医生的指导下用于诊断或处方或监测治疗的情况下使用;
2、它们根据指定的规格和剂量有专门的给药途径。
3、它们是口服、外用和/或吸入制剂;
4、第16c(1)(c)条规定的传统使用期限已过。这意味着,在申请日期之前的至少30年期间,该草药产品已在医学上使用,包括在欧盟内至少15年;
5、草药产品传统使用的数据是充分的;特别是该产品在规定的使用条件下证明不具有危害性,在长期使用和经验的基础上,药物的药理作用或功效是合理的。
第16a(2)补充说明,中草药产品中存在的维生素或矿物质,其安全性应有确凿的证据,只要维生素或矿物质的作用按照指定声明的指示对中药的活性成分是辅助的,就不得阻止产品基于传统使用的注册资格。
问题5:中草药产品申请可能采用哪种法律依据/类型?
答:不同的申请类型在NtA第2A卷第1章的第5节"申请类型"中有描述。
有关申请的法律依据的指南可在EMA网站上找到: http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/q_and_a/q_and_a_detail_000021.jsp&mid=WC0b01ac0580022711
有关草药产品的法律依据的例子有:
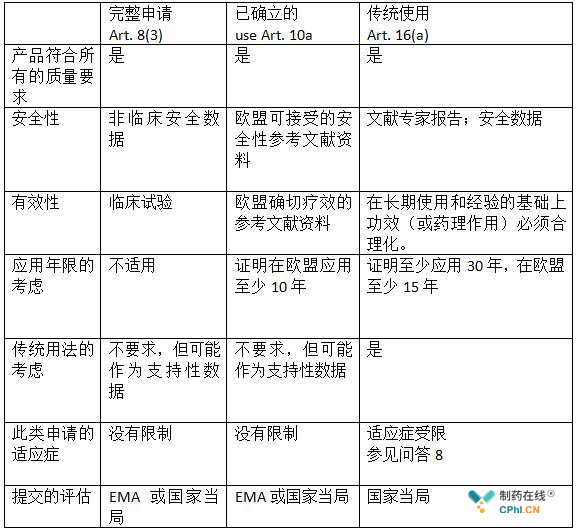
第8(3)-完整/独立的申请:根据指令2001/83/EC第8(3)条,完整的申请,需要提交药检、非临床试验和临床试验的结果。这种类型的申请(法律依据) 以中草药产品为例必须按照一种新中药材/中草药制剂来进行。这种申请可能包括申请人所做的有限的非临床和临床研究报告与参考文献相结合(所谓的"全混合申请-也可参见指令附件1第II.7部分的混合市场授权申请)。
第10a--已确立的申请:根据指令2001/83 / EC的10a条, 如果能证明一个医药产品的活性物质在欧盟范围内已经行之有效(WEU)至少10年以上,具有确认的疗效和可接受的安全水平,用详细的已发表的科学文献(公共领域可获得的信息)替代非临床和临床试验的结果是可能的。
关于WEU的具体指南可以在指示2001/83/EC附录1的第II.1部分中找到。
注:这两类申请都需要一份"完整档案",并在此基础上评估质量、安全性和有效性。这种申请不包括至少30年的药物使用证明的要求,包括在欧盟至少15年,作为替代人类试验和临床试验的临床证据。
第16a中药产品的传统使用注册:
为了克服各成员国在以统一的方式对传统草药产品申请药物立法时遇到的困难,2004年推出了简化注册程序。
简化程序允许中草药产品注册时无需安全性和有效性试验的详细情况和文件,前提是有足够的证据证明药用产品至少应用30年的时间,包括在欧盟至少15年。根据长期使用和经验,草药产品的功效被认为是合理的。如果根据传统使用的信息,草药产品在特定的使用条件下是无害的,那么非临床试验是不必要的。然而,即使是长期的传统(在欧盟内部或外部)也不排除可能存在对产品安全性的担忧,因此主管当局有权要求评估安全性所有必要的数据。
由于中草药产品的质量方面与传统用途无关,因此在申请文件的质量部分所要求的必要的物理化学、生物和/或微生物测试方面没有任何减少。产品应符合欧洲药典专著和/或成员国药典的质量标准。也可参见问答18。
在质量要求方面已经制定了许多科学指导方针。它们可以在这里找到:
问题6:是否可能将不同类型的申请需求组合在一个申请中?
回答6
不,这是不可能的。申请人提交一份申请文档时,必须在文件的管理模块1中注明提交卷宗的法律依据。法律依据的选择由申请人决定,但只能选择其中的一个法律依据。
如果在质量、安全性和有效性的证明上对一份完整的文档进行评估,传统的使用并不是科学评估的主要证据,尽管申请人可以选择将传统用途的信息作为支持性数据。
问题7:中草药产品的哪个适应症是在强制性的集中程序下进行评估?
回答7:对某些药品来说,集中程序是强制性的,对其他药品则是可选的。
对含有一种新活性物质的药物(在欧盟条例(EC) No 726/2004生效之日未获得授权,即2005年11月20日)治疗如下疾病中的一种,就是强制的:
o获得性免疫缺陷综合征(AIDS, HIV感染)
o癌症
o神经退行性疾病(包括痴呆和阿尔茨海默病)
o糖尿病
o自体免疫疾病和其他免疫功能障碍。
o病**疾病
含有一种新的活性物质的草药产品适应症必须根据完整的申请,按照集中的程序进行评估。根据他们的定义,这些适应症在任何申请中被排除在"传统草药产品"之外:"传统中草药产品"是在没有医生的指导下用于诊断或处方或监测治疗的情况下使用的产品。
在给定的适应症中已获得孤儿药地位的中草药产品会通过集中程序进行评估。
关于孤儿药产品的指南在EMA的网站可以找到:
对于含有新活性物质的其他药物而言,它是可选的,并且在其要求下,申请人表明它有明显疗效、科学或技术创新,或者在欧盟层面获得符合患者利益的授权。
在文件的"集中程序的强制性范围的科学及工作定义"(EMA/CHMP/121944/2007)和EMA预提交指导中,可以找到进一步的指南:
(未完待续)
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57