2018年4月24日,FDA宣布所有新型III型药物主文件(DMF)申请,以及现有DMFs的所有文件,以电子通用技术文件(eCTD)格式进行提交,将延长一年,也就是从原来规定的2018年5月5日延期到2019年5月5日。这已经是FDA第二次延长这一期限,去年,FDA同样在最初的2017年5月5日截止日期前几周宣布将eCTD强制实施期限延长一年。(如下图1)
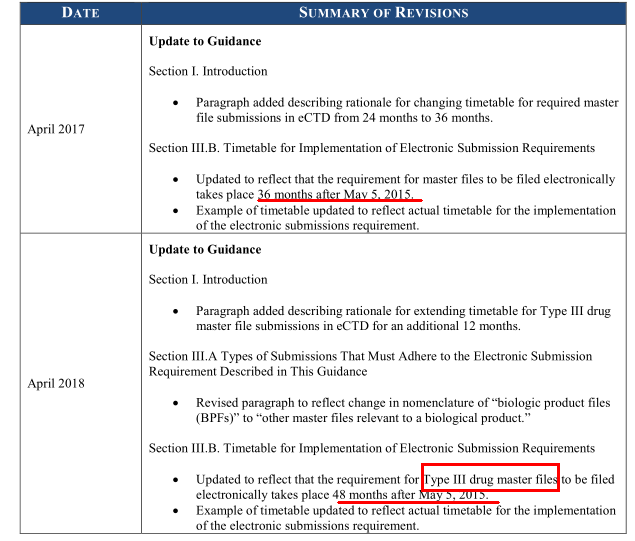
图1 指南文件两次更新内容
一般来讲,DMF根据申报的对象不同,可以分为以下五种,此次延期的就是 III型-包装材料,在FDA指南《电子格式的法规提交 - 使用eCTD来提交人用药物产品申请和相关资料》(Providing Regulatory Submissions in Electronic Format — Certain Human Pharmaceutical Product Applications and Related Submissions Using the eCTD Specifications)中对此次延期作了更新(图1)
I 型:组织与人员、设施与设备和标准操作程序;
II型:原料药、中间产品及其原料,制剂药;
III型:包装材料——容器;
IV型:赋形剂,着色剂,香料及其原料;
V型:可被FDA接受的其它信息;
eCTD实施背景介绍
eCTD的全称是Electronic Common Technical Document,即电子的CTD,其格式是由纸质提交一步步发展而来(图2)
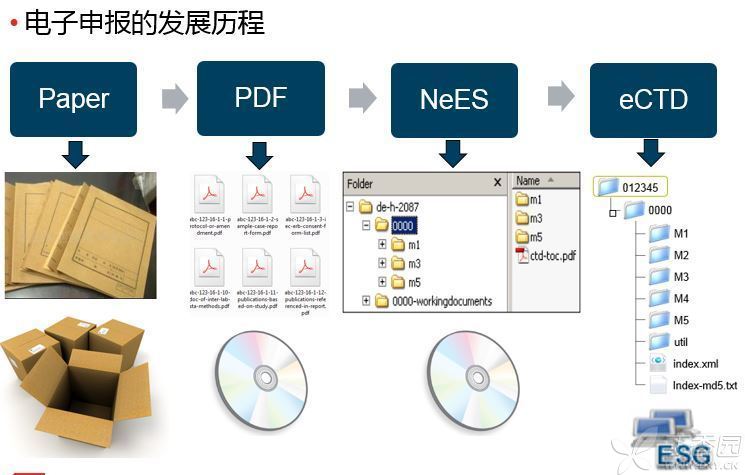
图2 电子申报的发展历程(来自丁香园)
2003年,ICH颁布了eCTD的指导文件,试行eCTD格式的电子申报,此后欧盟、美国、日本等地纷纷开始试行,到目前为止,全世界已有40多个国家地区推行了eCTD。
eCTD与传统的纸质递交相比,具有高效率、方便查看/导航、可快速溯源、实现生命周期管理、节约纸张等优势,正在成为全球药品注册申报的重要趋势,eCTD的格式包含了CTD格式内容+模块1(图3)。模块1的内容及要求根据申报的国家和地区各不相同,模块2-4国际通用。
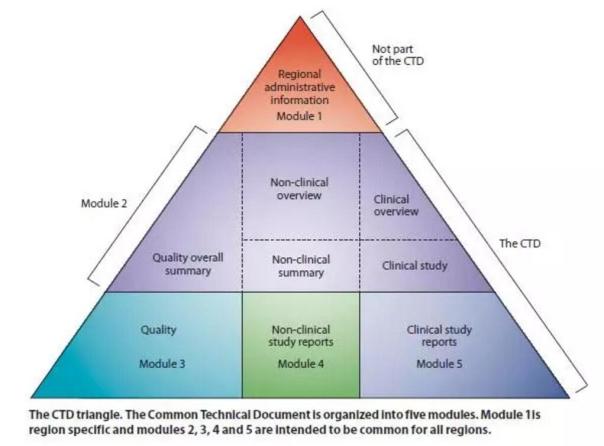
图3 eCTD格式
美国FDA在2005年发布了eCTD格式的基本要求,鼓励药品企业通过电子形式提交注册申请。2012年,“FDA安全与创新法案”(FDASIA)授权FDA要求药品和生物制剂企业使用特定的电子格式向该机构提交材料。然而,为了达到使用特定的电子格式的要求,FDA必须在发布完整的指导准则24个月后给行业订出要求的标准和时间表。
2015年5月,FDA发布指南《电子格式的法规提交 - 使用eCTD来提交人用药物产品申请和相关资料》,要求对新药申请(NDAs),仿制药申请(ANDA),生物制品申请(BLA)和主文件(Master Files)使用eCTD格式,指南中还对各种不同类型的申请强制执行eCTD的时间作了规定。2017年4月,FDA延迟了药物主文件(DMF)和生物制品文件(BPF)以eCTD格式提交的要求,新的日期为2018年5月5日,当时FDA的官方解释是制药企业反馈,按照2017年5月5日这个时间期限,药物主文件若采用eCTD提交,可能带来主文件提交失败率升高,从而导致FDA审评流程放慢。
|
申报类型 |
执行起始日期 (2015年5月版) |
执行起始日期 执行起始日期 (2017年4月更新版) (2018年4月更新版) |
|
|
NDA |
2017-05-05 |
2017-05-05 2017-05-05 |
|
|
NDA |
2017-05-05 |
2017-05-05 2017-05-05 |
|
|
BLA |
2017-05-05 |
2017-05-05 2017-05-05 |
|
|
Master Files |
2017-05-05 |
2018-05-05 2019-05-05(III型) |
|
|
商业IND |
2018-05-05 |
2018-05-05 2018-05-05 |
|
时隔一年, FDA第二次延长最后期限。这一次,FDA表示截止日期的延长是因为DMF用eCTD提交拒绝率非常高;FDA还进一步解释说,“因为III型DMFs通常提供有关包装或包装材料的信息,以支持NDAS,ANDA,或BLAS申请。如果申请人因为采用eCTD原因应该提交或不再提交eCTD形式的DMF,这可能导致药物供应中断。”因此这次延期只适用于III型的DMFs。
随着计算机技术发展,各国药政机构为了节省储存空间,推动工作效率提升,都不断推出eCTD等电子申报形式。目前中国CNDA也开始启动eCTD工作流程。随着工作的持续推进,也会遇到很多疑难问题。希望此文可以为中国药政机构提供借鉴。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57