目前,人们还沉浸在世界杯的狂热之中,每天不断关注着绿茵场上的喜怒哀乐。作为和人类健康密切相关的制药行业,任何风吹草动都会引发公众的关注。随着2018年已悄然过半,从来不缺乏热点的制药行业依然风起云涌:生物制药持续火热,细胞基因治疗热度不减,医药产业并购、重大资产重组不断。欧美市场在2018年上半年表现如何,笔者为各位简要介绍一二。
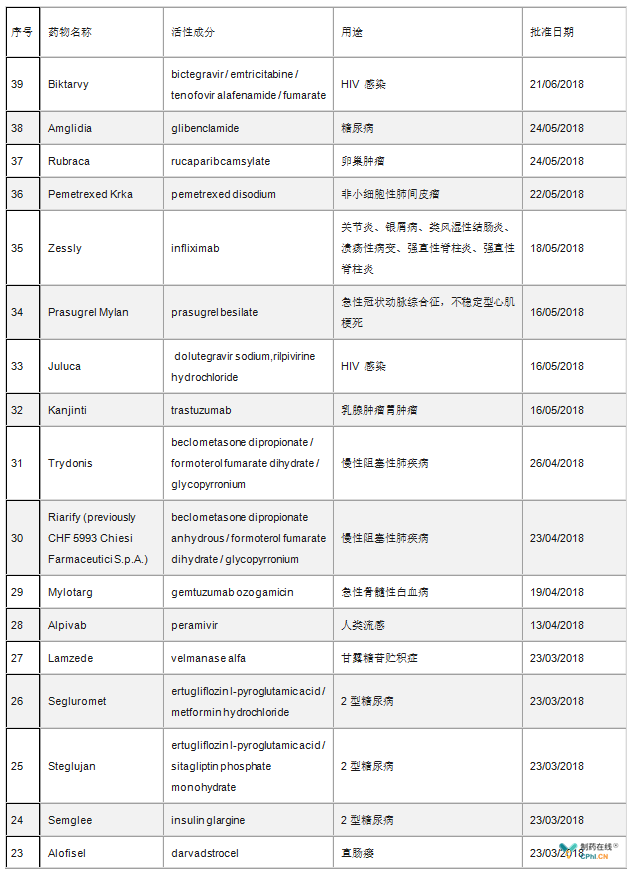
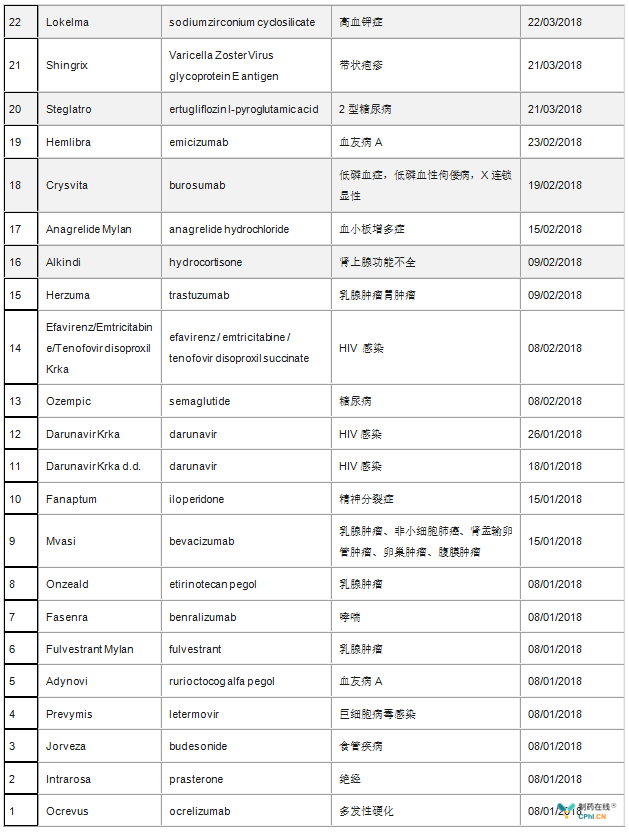
美国FDA和欧盟一直是制药企业的风向标,一直是全球健康产业媒体关注热点。在新药审批方面,据统计,2018年上半年FDA共批准17个新药,包括5个生物制品许可申请(BLA)和12个新分子实体(NME),其中8个获得了孤儿药资格,8个被认定为优先审评(详见表1)。而欧盟2018年上半年共批准了39个新药,其中包括9个孤儿药(详见表2)。
表1 2018年上半年FDA批准的新药
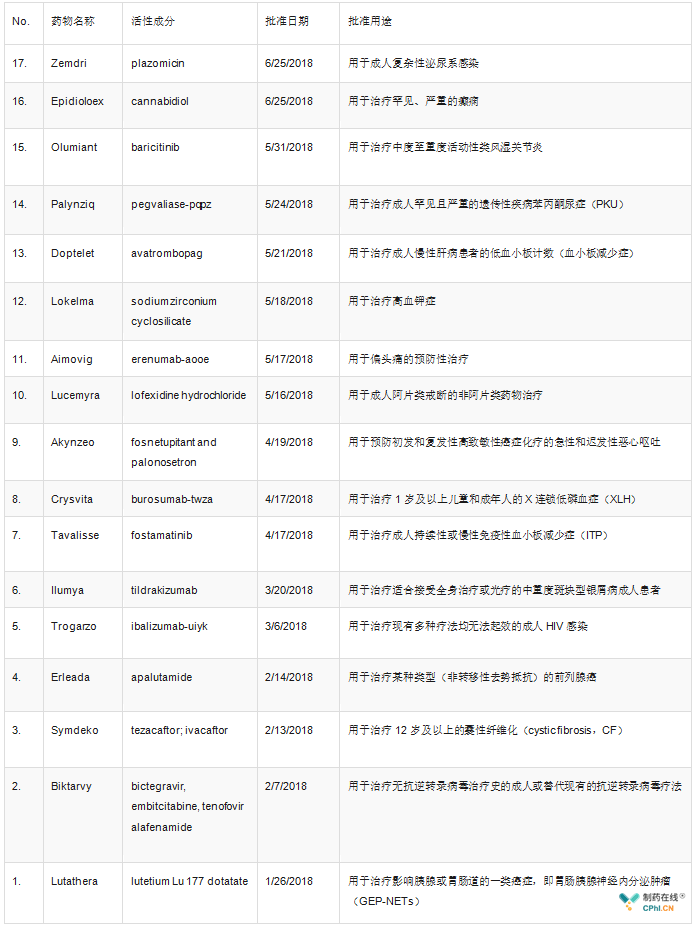
表2 2018年上半年欧盟批准的新药
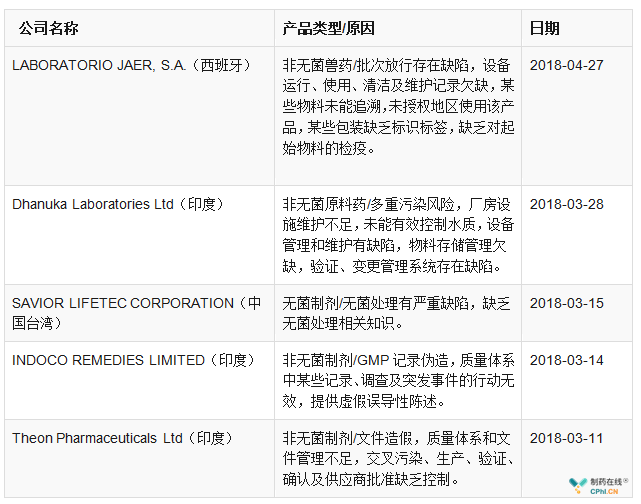
在制药企业监管方面,FDA和欧盟依然保持严格谨慎和科学的监管态势,上半年,FDA共签发警告信33个,涉及11个国家(图1),这其中原料药企业10个,制剂企业23个(详见表3)。从分布国家来看,自2017年11月1日美国与欧盟(EU)人用药用互认检查协议(MRA)正式开展以来,欧盟和美国的检查资源重新布局,亚洲仍是重点监管对象,而中国、印度作为监管的重灾区;要想取得更好的合规业绩和获得市场认可,必须从根本上加强GMP管理,完善自身生产质量管理体系。欧盟GMP不符合性报告共5份,包括1个原料药和4个制剂产品(其中一个为兽药产品)(详见表4)。
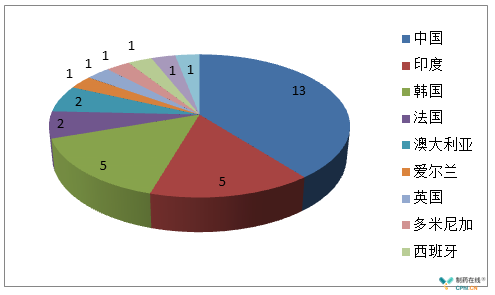
图1 2018年上半年FDA警告信国家分布
表3 2018年上半年FDA警告信汇总
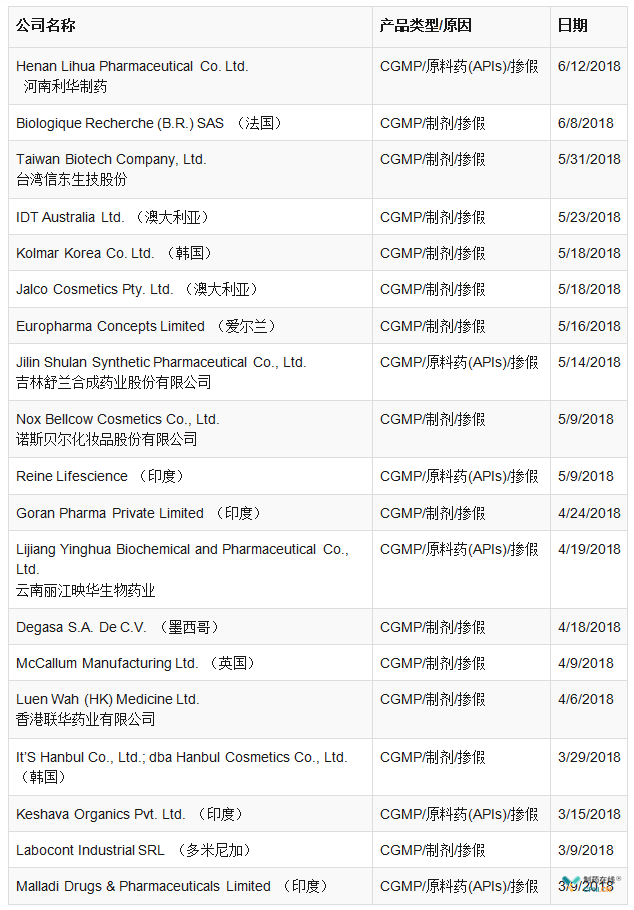
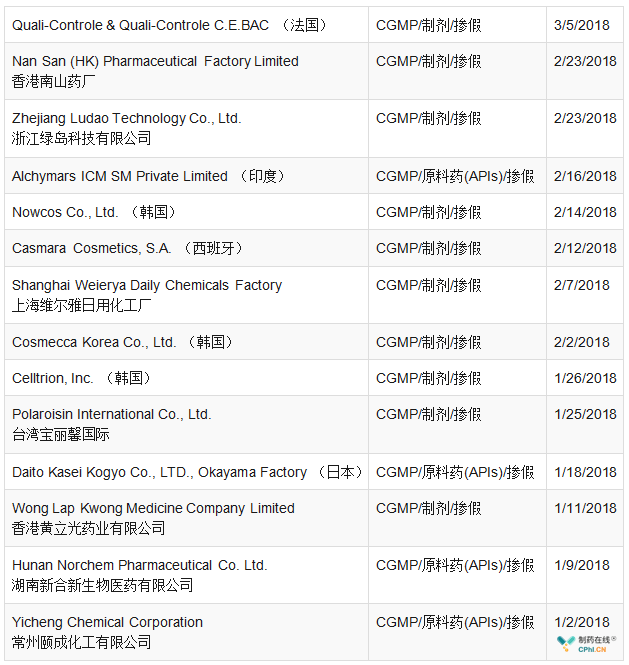
表4 2018年上半年欧盟GMP不符合报告汇总
参考资料:
1、Novel Drug Approvals for 2018
2、FDA、欧盟及EudraGMDP官方网站信息。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57