
2019年05月07日,Akcea Therapeutics反义核酸药物Waylivra (volanesorsen)迎来里程碑式进展,EMA有条件批准 (conditional marketing authorization)该药物用于FCS( 家族性乳糜微粒血症综合征),由于药物具有血小板减少风险,上市将会继续进行安全性研究。
Waylivra (volanesorsen) 是反义核酸药物,能够减少ApoC-III产生,改善FCS患者甘油三酯水平,从而缓解患者疾病症状。
volanesorsen 的上市之路并不顺利,根据公开资料:
2017年07月27日,volanesorsen向 EMA递交上市申请
2017年08月31日,volanesorsen向 FDA递交上市申请;
2017年11月15日,volanesorsen上市申请获EMA,FDA受理;
2018年05月10日,FDA专家咨询委员会12:8投票支持volanesorsen;
2018年08月27日,由于血小板减少风险,volanesorsen上市申请遭FDA拒绝;
2019年03月01日,EMA下属CHMP对volanesorsen上市给出积极建议;
2019年05月07日,EMA有条件批准用于FCS,全球首款!!!
本文关注volanesorsen关键临床试验数据以及血小板减少风险。
一. 关键临床试验数据APPROACH和COMPASS
目前,volanesorsen已完成APPROACH和COMPASS临床试验,APPROACH OPEN LABEL临床试验尚未完成。这3项临床试验是支持药物上市申请的关键临床数据。

Akcea Therapeutics官网
APPROACH-NCT02211209
APPROACH招募FCS患者66例,1:1入组试验组和对照组,
主要终点为用药3个月时TG水平变化
该临床数据已发表,详细可参考Digenio A, Dunbar RL, Alexander VJ, Hompesch M, Morrow L, Lee RG, Graham MJ, Hughes SG, Yu R, Singleton W, Baker BF, Bhanot S, Crooke RM. Antisense-Mediated Lowering of Plasma Apolipoprotein C-III by Volanesorsen Improves Dyslipidemia and Insulin Sensitivity in Type 2 Diabetes. Diabetes Care. 2016 Aug;39(8):1408-15. doi: 10.2337/dc16-0126. Epub 2016 Jun 6.
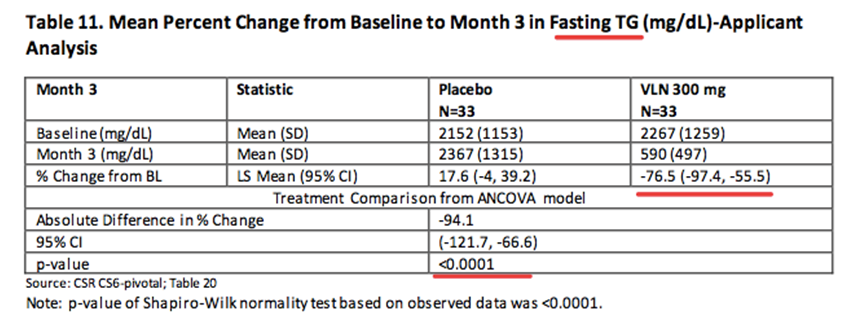
该研究达到主要终点,Volanesorsen能将患者TG水平降低77%,安慰剂仅为17.6%,Volanesorsen能够明显降低FCS和严重高甘油三酯血症患者的TG水平,临床收益显著。
COMPASS-NCT02300233
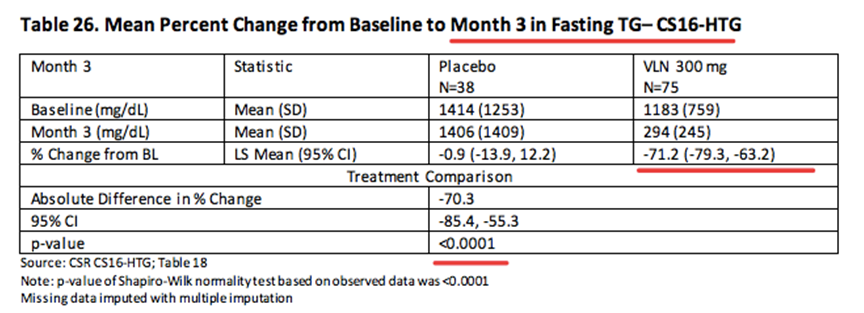
COMPASS是一项随机、双盲、安慰剂对照的3期临床试验,评价300 mg Volanesorsen在严重高甘油三酯血症患者中(TG ≥500 mg/dL)的有效性。试验数据显示,Volanesorsen同样能够显著降低患者TG水平,达到临床终点。
APPROACH OPEN LABEL-NCT02658175
此临床试验尚未结束,该试验招募3类患者,即已参与并顺利完成上述APPROACH和COMPASS试验的患者,第3类是新招募患者。该临床试验仍在进行中。
二. 血小板减少风险
上文中,APPROACH和COMPASS临床试验毫无疑问证实volanesorsen能够给患者带来非常显著的临床收益,但是,临床试验中volanesorsen的血小板减少风险不容忽视,数据显示:
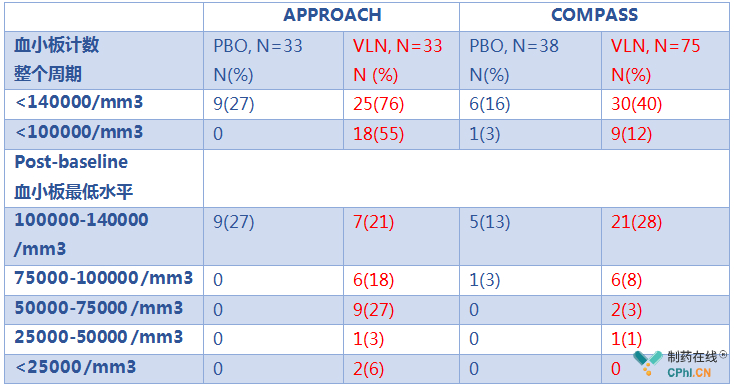
Volanesorsen可引起血小板减少,无论是整个临床试验期间还是post-baseline期间,volanesorsen均能够引起药物相关的血小板减少。血小板减少风险是FDA拒绝批准药物上市最重要原因,同样也是EMA有条件批准的主要原因,药物上市后的安全性研究仍需继续关注。
点击下图,观众预登记成功送20元话费



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57